
David Jenny, Serge Denis, Heinrich Haller mit Illustrationen von Lea Gredig


David Jenny, Serge Denis, Heinrich Haller mit Illustrationen von Lea Gredig
Carl Stemmler gewidmet –dem Pionier der Schweizer Steinadlerforschung
David Jenny, Serge Denis, Heinrich Haller mit Illustrationen von Lea Gredig
Haupt Verlag
2| Körperbau
Die Unterarten des Steinadlers – geografisch bedingte Feinanpassungen
Alte Steinadler verlieren an Spannkraft
Vom Jugendkleid zum Alterskleid – eine Metamorphose 41
Ausgebleichte Federn helfen bei der Altersbestimmung 44
Ein symmetrischer Federwurf – Serge Denis 46
Die Mauser – ein stetiger Erneuerungsprozess 47
Kampfopfer-Spuren kontra Hungerstreifen 50
4| Jagdverhalten und Ernährung
zu tragen?
Beuteschlag – nur jeder zehnte Versuch ist erfolgreich
Erfolgreich Beuteschlagen – eine kognitive Parforceleistung
Tierkadaver sind die Treiber für Wanderungen von Jungadlern
Unsichtbare Reviergrenzen werden respektiert
Attacken können tödliche Folgen haben
Die Zahl der Kampfopfer ist gestiegen 113
Der Girlandenflug – ein klassisches Steinadlerverhalten 114 Konkurrenz als Schlüsselfaktor 116
Selbstregulation – ein universelles Phänomen bei tierischen Populationen 117
Mit zahmen Adlern unterwegs für die Wissenschaft 122
Die räumliche Trennung innerhalb der Reviere verstärkt den Einzeladler-Effekt 124
Neue Strategien als Antwort auf neue Herausforderungen 127 Zwischenartliche Konkurrenz 136
3| Verbreitung, Lebensraum, Nahrungsgrundlage 55
Verbreitungslücken und Überwinterungsgebiete – zum
Brüten reicht es nicht 57
Ist der Steinadler ein Vogel der Gebirge? 58
Steinadler sind auch Flachländer 60
In der Schweiz lebt 98 % des Steinadlerbestands in den Alpen
6| Fortpflanzung 141
Horste 142
Der Steinadlerhorst von Carl Mosca in der Val Sinestra 146
Besonderheiten bei Steinadlerhorsten 150
Fruchtbarkeit, Eiablage, Gelegegröße 164
Relativ große Eier, manchmal taub und sehr selten als Nachgelege 165
Konstante Brutperioden, aber individuelle Unterschiede 166
Ablösungen beim Brutgeschäft – das Weibchen dominiert 168
Kainismus 174
Geschlechterrollen der Altvögel bei der Jungenaufzucht 176
Bruterfolg, Nachwuchsrate, Brutgröße – Messgrößen für die Fortpflanzung 179
Bettelflugphase 185
Jungadler erhalten einen Sender 188 Technologische Entwicklungen ermöglichen
Erkenntnis-Schübe 194
8| Todesursachen, Gefährdung und Schutz des Steinadlers 213 Relativ hohe Überlebensraten 214 Tod durch Gift 216 Tödliche Kollisionen mit Kabeln 222
Besetzte Horste vor Störungen aus der Luft besser schützen 225 Störungen am Brutplatz 228
Gemäß der «Roten Liste» nicht mehr gefährdet – trotzdem bleibt der Bestand verletzlich 231
9| Synthese und Ausblick 233
Die Alpenpopulation im Kontext der weltweiten Verbreitung 234
Gefährdungsrisiken mit Fokus auf die Schweiz 236 Rückblick und Ausblick 237 Schlussbemerkungen 240 Wie wir zu Adlerforschern wurden
7| Entwicklung der Population in den Alpen, im Mittelland und im Jura 197
Bestandsaufnahmen und -trends als Grundlage für den Artenschutz 198
Im Horstfieber – Herausforderungen und Nutzen von Bestandsaufnahmen und des Brutpaarmonitorings 198
Rückeroberungen seit dem Bestandstiefpunkt 200
Im Alpenraum – Verdichtung nach innen 204 Bestandswachstum im Wallis 209 Die Schweizer Alpenpopulationen im Vergleich 210 Heimatliebe 211
Die Autoren und die Illustratorin
Ergänzende Abbildungen und Tabellen
«Ich rieche nichts», meinte mein Partner bei einer Sendermontage, der Aufforderung zum Hinhalten der Nase folgend. Stets, wenn ich einen unserer Steinadler-Nestlinge in den Händen hielt, musste ich tief einatmen. Dieser puderartige, sanfte und doch herbe Geruch von Jungadlern war bei mir mit positiven Assoziationen verknüpft. Gerüche werden im Langzeitgedächtnis insbesondere dann gespeichert, wenn sie mit Emotionen in Verbindung stehen. Bei Steinadlern waren es ganz offensichtlich Momente des Glücks. Die Leidenschaft für Steinadler teile ich zwar mit anderen Naturfreunden, derart diesem Vogel verfallen wie ich es bin, sind in der Schweiz aber wohl nur eine Handvoll Gleichgesinnte. Dazu gehören die beiden Mitautoren dieses Buches, Heinrich Haller und Serge Denis. Der charismatische Steinadler eignet sich besonders gut zur Entfachung einer Leidenschaft; er faszinierte die Menschen seit jeher und ist gerade auch deswegen mit Mythen beladen worden. Die Herausforderung für Forscher bestand und besteht daher darin, die sogenannten Könige der Lüfte von ihren Legenden zu befreien und mit nüchternem Blick deren wahre Lebenshintergründe zu beleuchten. Das ist in der heutigen Zeit des raschen Wandels notwendiger denn je, denn nur durch adäquates Wissen lassen sich die aktuellen Bedürfnisse potenziell gefährdeter Tierarten erkennen, wodurch letztlich die richtigen Artenschutz-Maßnahmen ergriffen werden können.
Die weltweit verbreiteten Steinadler haben in der Schweiz ihre ganz eigene Geschichte durchgemacht, die dank Pionieren wie Carl Stemmler heute sehr gut dokumentiert ist. Der Schaffhauser Stemmler, der auch zur Gilde der Steinadlerbefallenen gehörte, hatte in der Mitte des 20. Jahrhunderts den Keim für die nächsten Generationen von Steinadlerforschern gesetzt. Dazu zählen auch die Autoren dieses Buches, welche ihre Erkenntnisse wiederum an die heutige Forschergeneration weiterreichen.
Die Perspektive, welche das Buch aufzeigt, ist eine Mischung aus Rückschau, Kompilation aktuellen Wissens und Einblick in die moderne Forschung. Wenn wir manchmal in ökologische Erkenntnisebenen abschweifen oder eigene menschliche Befindlichkeiten beschreiben, so werden wir doch stets den Steinadler als Protagonisten im Zentrum behalten. Einen besonders genauen Blick werfen wir auf die Kan-
tone Graubünden mit dem Engadin, auf das Wallis und den Kanton Bern.
Die bewegte Geschichte des Steinadlers steht auch stellvertretend für dessen Lebensräume in den vielerorts wild gebliebenen Alpen, dem in Mitteleuropa mit Abstand größten naturnahen Raum. Und für andere Beutegreifer, deren Ruf auch heute noch oder sogar verstärkt wieder beschädigt wird. Unser Fokus beleuchtet immer wieder die Verletzlichkeit des Steinadlers und von Beutegreifern ganz allgemein. Diese latente Gefährdung wird nirgends so deutlich wie in den Adler-Kinderstuben. Besetzte Horste bilden eine Intimsphäre, welche absoluten Schutz erfordert. Störungen an Brutplätzen durch Horstfotografie kommen in der Schweiz leider häufiger vor als anderswo. Wir verzichten daher – abgesehen von wenigen historischen – auf Nahaufnahmen während der sensiblen Brutphase und zeigen stattdessen eigens angefertigte Bleistiftzeichnungen unserer äußerst engagierten Illustratorin Lea Gredig.
Steinadler neigen dazu, uns Menschen pathetisch werden zu lassen. Dem begegnen wir mit der nötigen Reserve, denn wir wollen faktenbasiertes Wissen vermitteln. Und doch empfiehlt es sich manchmal, die Symbolhaftigkeit des großartigen Jägers und Seglers zu bemühen. Im besten Sinn für alle, denn wer sonst soll uns besserer Botschafter sein für den Schutz der alpinen Landschaften, als dessen unbestrittener fliegender König.
David Jenny, Zuoz, im Juni 2025
Nachfolgende Doppelseite Frühe fotografische Aufnahme mit Jungadler und Horstanflug eines Altvogels aus den 1930erJahren im Berninagebiet (im Hintergrund mit Piz Palü). Als einer der Ersten filmte Bartholomé Schocher aus Pontresina das Brutgeschehen an einem Steinadlerhorst in luftiger Höhe (B. Schocher, Mitte der 1930er-Jahre, Pontresina GR. Archiv A. Lochau).




Steinadler Graubünden: Anzahl ausbezahlte Schussgelder
187818801882188418861888189018921894189618981900190219041906190819101912191419161918192019221924192619281930193219341936193819401942194419461948195019521954195619581960
bei welchem am Haut de Cry ein Jungadler verbrannte, nachdem von oben Fackeln in den Horst geworfen wurden (Bericht von Wildhüter René Fellay 9.11.1947).
Hand in Hand mit den hohen Abschusszahlen gingen auch sogenannte Aushorstungen. Dabei holte man Jungadler im Nestlingsalter aus ihren Horsten. Solche Aktionen sind in Graubünden schon aus dem frühen 19. Jahrhundert dokumentiert (Steinmüller 1821; Conrad von Baldenstein 1981). Ausführliche Medienberichte über Aushorstungen fallen in die letzten Dekaden des 19. Jahrhunderts. Im Oberengadin wurden derlei Aktionen zwischen 1890 und 1897 fast alljährlich unter Beteiligung von lokaler Prominenz (Abb. 8) und Reportern durchgeführt. Dabei packten Horstbesteiger jeweils ein oder zwei etwa fünfwöchige Nestlinge in Stoffsäcke, die anschließend zu Boden gelassen wurden. Die Jungadler gelangten danach in der Regel in Volieren, wo sie zur Schau gestellt wurden und meist nicht lange überlebten. Detaillierte, oft durchaus kritische Medienberichte dokumentierten die Aufsehen erregenden Aktionen (siehe Kasten Seite 18).
Tiefpunkt und Umdenken
Die kritischen Kommentare zu Aushorstungen waren die Vorboten einer Veränderung im Verlauf des 20. Jahrhunderts, diesmal zugunsten der Beutegreifer. Innerhalb weniger Jahrzehnte wechselte der gesellschaftlich konforme Modus gegenüber Wildtieren, und ganz besonders gegenüber Raubtieren, von Übernutzung, Verfolgung und Ausrottung hin zu Akzeptanz,
Schutz und sogar aktiver Wiederansiedlung. Beim Alpensteinbock, beim Luchs und beim Bartgeier äußerte sich diese Umwälzung in extremis und hatte große Auswirkungen auf die Bestandsentwicklung vieler weiterer Arten. Auch der Steinadlerbestand in den Alpen und anderswo in Europa begann sich zu erholen, vorerst allerdings langsam. Die Hintergründe für diesen gesellschaftlichen Änderungsprozess sind komplex und bedürften eines kulturhistorischen Blickwinkels, der hier nur ansatzweise beleuchtet werden kann. Im 19. Jahrhundert vermischten sich verschiedene Denkrichtungen zu einem neuen Naturverständnis, beeinflusst von den Vorstellungen aus der Aufklärung (z. B. Jean Jacques Rousseau 1712–1778) und etwa ein Jahrhundert später durch die Evolutionstheorie von Charles Darwin (1809–1882). Die Naturwissenschaften machten weiterhin rasche Fortschritte, ökologisches Denken fasste Fuß und verdrängte langsam die bisher stark durch ein christlich-moralisch geprägtes Weltbild dominierte Sichtweise auf die Natur. Technologien erreichten in kurzer Zeit enorme Fortschritte, Datenerhebungen und deren Auswertung wurden stetig effizienter (Feldstecher, Fernrohr, Kartengrundlagen, Autos, Computer, GPS-Technologien, Künstliche Intelligenz etc.). Der wissenschaftliche Austausch wurde durch Verbesserungen bei Kom-
Abb. 6 Anzahl von im Kanton Graubünden ausbezahlten Schussgeldern für Steinadler. 1914, 1925 und 1939 blieb die Bündner Jagd offiziell geschlossen (Landesberichte des Kantons Graubünden 1878-1953).


munikationsmitteln immer einfacher. Diese gesellschaftlichen Entwicklungen, die während der Industrialisierung einsetzten, spielten sich in nie zuvor gekannter Geschwindigkeit ab und folgten einem Beschleunigungsmuster. Sie hatten und haben mannigfaltige Auswirkungen auf die Natur, oft negative. Auf der Gewinnerseite standen – zumindest bis zum Beginn des 21. Jahrhunderts in Europa – eine Reihe von Vertretern der Megafauna, deren Akzeptanz in der öffentlichen Wahrnehmung stieg. Dazu gehörten viele Prädatoren, insbesondere die Greifvögel.
Bevor wir uns aber dem Wiedererstarken der großen Wildtierarten inklusive dem Steinadler zuwenden, werfen wir nochmals einen Blick auf die Tiefpunkte der Bestandsentwicklung einiger großer Greifvögel und des Uhus Bubo bubo. Der letzte
Abb. 7 Der Adlerkönig Leo Dorn hatte als bayerischer Berufsjäger zwischen 1881 und 1912 etwa 80 Steinadler erlegt und galt in seinem Heimatort Oberstorf im Allgäu als Volksheld (Foto: J. Heimhuber, um 1910). © Fotohaus Heimhuber.
Abb. 8 Der berühmte Engadiner Kunstmaler Giovanni Segantini mit einem aus dem Nest geholten Steinadler. Eine Aushorstung mit Segantini fand im Juli 1898 in der Val Chamuera GR statt. Die zwei entnommenen Jungadler gingen zunächst in den Besitz Segantinis nach Maloja, von wo sie später in den Zoologischen Garten von Berlin gelangten (Kulturarchiv Oberengadin, Zuoz. Fotograf unbekannt).
Brutnachweis des Fischadlers Pandion haliaetus in der Schweiz erfolgte 1911 bei Ellikon am Rhein. Zuvor wurden dort alljährlich Fischadler am Brutplatz abgeschossen (Stemmler 1932). Bartgeier brüteten noch bis gegen 1890 in Graubünden. Ein letzter Brutnachweis erfolgte im Lugnez im Jahr 1886 (Glutz von Blotzheim et al. 1971). Im Alpenraum wurde der letzte Bartgeier 1913 im Aostatal geschossen, danach galt er hier als ausgestorben bzw. ausgerottet. Auch Uhus wurden europaweit verfolgt. In der Schweiz brüteten nur noch wenige Paare, als sie ab 1925 unter Schutz gestellt wurden (Jenny 2012). Beim Wanderfalken Falco peregrinus sind die Ursachen für den Niedergang in Europa vielfältiger und er erfolgte mehrere Jahrzehnte später. Die Gründe sind aber ebenso menschbedingt und umfassen Eierraub, Aushorstungen in erster Linie für die Falknerei, Abschüsse und vor allem den Einsatz von Pestiziden wie DDT. Der Tiefpunkt in der Schweiz lag beim Wanderfalken um 1970, als der Bestand auf noch etwa 30 Paare geschätzt wurde (Maumary et al. 2007). Starke Bestandseinbußen bzw. -zusammenbrüche waren auch beim Steinadler in den Alpen zu verzeichnen. Im Jura war er bereits vor 1850 verschwunden (Meisner & Schinz 1815). Auch in anderen Regionen außerhalb der Alpen West- und Mitteleuropas verschwand der Steinadler als Brutvogel im Verlauf des 19. Jahrhunderts oder früher. So in England, in den Vogesen, in vielen deutschen Mittelgebirgen und in den norddeutschen Tiefebenen (Mecklenburg, Pommern, Brandenburg). Eine Auflistung findet sich im Anhang (Tab. 1)
Der Begriff «Aushorstung» stammt ursprünglich aus der Falknerei und bezeichnet die Entnahme von noch nicht flüggen Falken und Eulen aus ihren Nestern. Die Vögel wurden dann für die Falkenjagd abgerichtet. Im Zusammenhang mit Steinadlern wurden Aushorstungen im Glauben ausgeführt, etwas gegen die schädlichen Raubvögel unternehmen zu müssen. Zudem gab es Kopfprämien für jeden der Natur entnommenen Steinadler, ob tot oder lebendig. Begehrt waren sie auch als Trophäen, welche in präparierter Form in private Sammlungen oder Museen gelangten. Aus allen Teilen der Alpen wurden Aushorstungen bekannt. Deren Einschätzung in der öffentlichen Wahrnehmung wechselte im Verlauf der letzten Jahrzehnte des 19. Jahrhunderts mehr und mehr von einem «wichtigen Beitrag für die Vertilgung von Raubzeug» zu «Frevel an der Natur». Trotzdem gelangten zwischen 1904 bis 1922 noch fünfzehn Aushorstungen und dreizehn Abschüsse am Horst in die Schweizer Presse, von Karl Daut im Ornithologischen Beobachter fein säuberlich dokumentiert. Diese Taten wurden von Daut ausnahmslos verurteilt und Geschichten über vermeintliche Adlerschäden oder Heldentaten gegenüber blutrünstigen Steinadlern hinterfragt oder widerlegt. Im Oberengadin sind zwischen 1892 und 1898 fünf Aushorstungen ausführlich beschrieben worden. In vier aufeinanderfolgenden Jahren berichtete die Engadiner Post über die Aktionen, die beim Adlerpaar Bernina am Piz Chalchagn (Abb.9), in der Val Roseg und in der Val Chamuera stattfanden. Mit von der Partie waren unter anderem der bekannte Arzt Dr. Oscar Bernhard (Organisator), Schriftsteller J.C. Heer (Autor von «Der König der Bernina») und der berühmte Kunstmaler Giovanni Segantini aus Maloja (Abb.8). Wildhüter oder Bergführer seilten zum Horst ab und entnahmen die noch nicht flüggen Jungadler dem Horst. Die Beschreibungen dieser Aktionen, später auch literarisch verarbeitet, waren oft kaum an Dramatik zu überbieten: «…die Tiere zerfleischten ihr [Frau Feuerstein] mit Schnabel und Krallen die Arme, dass ihr das Blut über die Hände strömte… (J.C. Heer 1932)». Bartholomé Schocher (1939) beschrieb eine Aktion am Eingang der Val Roseg im Jahr 1892, in welcher ein 16-jähriger Jüngling mit einer Angelrute zum Horst abgeseilt wurde. Er zog eine Schlinge um den Hals des Jungadlers und wurde ihm so habhaft, hatte dabei aber – am freien Seil hängend – selber große Ängste ausgestanden, die ihm bis ins hohe Alter präsent blieben.
In den Kommentaren, die auch in der Neuen Zürcher Zeitung erschienen, waren oft auch kritische, hinterfragende Bemerkungen zu lesen: «…man möchte doch dem epidemisch gewordenen Adlerfang Einhalt gebieten». Letzte Aushorstungen wurden in den 1920er-Jahren dokumentiert, so etwa im schwyzerischen Muotathal, als ein Knabe 1922 in einem Korb zum Horst heruntergelassen wurde, wo er den Jungadler in einen Käfig steckte (Ornithol. Beob 2/1922). Die gefangenen Jungadler gerieten meist in Volieren, wo sie gefüttert und zur Schau gestellt wurden und meist nicht lange überlebten. Präparate aus dieser Zeit finden sich noch heute in zahlreichen Sammlungen, Museen und Schulhäusern.
Abb.9 Aushorstung zweier Jungadler im Juni 1895 bei Pontresina. Mit von der Partie waren der bekannte Arzt und Heliotherapeut Oscar Bernhard (2. von links), Fabrikant Carl Weber aus Winterthur (3. von links), Wildhüter Danuser (ganz rechts) und der junge Wildhüter-Aspirant Andrea Rauch, der in den Horst abseilte (im Hintergrund). Diese Aufnahme ist das wahrscheinlich älteste fotografische Dokument des Steinadlers in Graubünden. (A. Flury 1895).

Gattung Aquila (Echte Adler; Brisson 1760)
Raubadler (oder Savannenadler)
Steppenadler
Östlicher Kaiseradler
Iberienadler (oder Westlicher Kaiseradler)
Molukkenadler (oder Gurney’s Adler)
Keilschwanzadler
Steinadler
Schwarzachseladler (oder Cassin’s Adler)
Klippenadler (früher Kaffernadler)
Habichtsadler
Afrikanischer Habichtsadler (oder Akazienadler)
Bevor wir die Körpermaße, das Gefieder und die Mauser genauer betrachten, werfen wir einen Blick auf die heute bekannten Unterarten des Steinadlers.
Die Unterarten
des Steinadlers –geografisch bedingte Feinanpassungen
Unterarten sind Varietäten von Steinadlern, die sich während der jüngsten Stammesgeschichte isoliert entwickelten und genetisch differenzierten. Im Gegensatz zu Arten bestehen zwischen Unterarten keine Fortpflanzungsschranken. Deren morphologische Unterscheidung basiert einzig auf einem eingeschränkten genetischen Austausch aufgrund von geografischer Distanz. Diese Unterschiede sind aber klein und äußerlich schwer zu erkennen; zudem gibt es stets auch Übergangsformen. Sie bedürfen einer genauen, vergleichenden Untersuchung von Körpermerkmalen, heute ergänzt durch Ergebnisse genetischer Analysen. Die Unterteilung erfolgte in der Vergangenheit – je nach Autor – in bis zu 14 Unterarten (Hartert 1922, Dementjew & Gladkow 1951, Vaurie 1965).
Im holarktischen, einen großen Teil der Nordhemisphäre umfassenden Verbreitungsgebiet des Steinadlers, lassen sich gemäß Fischer (1995) zwei biologische Gruppen unterscheiden: eine Waldgruppe im Norden und eine Gebirgsgruppe im Süden. Diese sind aber aufgrund der weiten Ausbreitung keinesfalls einheitlich und lassen sich auch nicht morphogenetisch unterscheiden: Die Vögel zeigen geringfügige Anpassungen an die verschiedenen Lebensräume und Überlebensstrategien. Der stärkste Größenunterschied ist zwischen den großen Formen
Aquila rapax (Temminck, 1828)
Aquila nipalensis (Hodgson, 1833)
Aquila heliaca (Savigny, 1809)
Aquila adalberti (C.L. Brehm, 1861)
Aquila gurneyi (G.R. Gray, 1861)
Aquila audax (Latham, 1806)
Aquila chrysaetos (Linnaeus, 1758)
Aquila africana (Cassin, 1865)
Aquila verreauxii (Lesson, 1831)
Aquila fasciata (Vieillot, 1822)
Aquila spilogaster (Bonaparte, 1850)
in Zentralasien und Ostsibirien und den wesentlich kleineren Steinadlern in Korea und Japan zu erkennen. Auch die nordamerikanische Form ist kleiner als die Nominatform Aquila chrysaetos chrysaetos (diese beschreibt die namensgebende Unterart, die als Vergleichsbasis herangezogen wird). Haller (1996) führt die Größenunterschiede mindestens teilweise auf Anpassungen an die Größe der wichtigsten Beutetiere zurück. Während im Norden des Areals und in den Alpen größere Huftiere wie Rentiere oder Gämsen geschlagen werden, sind es in Nordamerika oder Japan kleinere Tiere wie Hasen, Kaninchen oder Fasane. Die bezüglich Größe zwischen den sibirischen und fernöstlichen Formen liegende Nominatform wird auch als Goldadlertypus mit viel rostbräunlichen Tönen im Gefieder beschrieben. Allerdings bestehen aufgrund von alters- und mauserbedingten Gefiederausbleichungen durch das Sonnenlicht auch erhebliche individuelle und phasenbedingte Unterschiede bezüglich Gefiederfärbung. Generell haben die südlichen Formen aber ein dunkleres Grundgefieder. Dazu gehören die Steinadler aus Spanien, Nordafrika, Afghanistan, Pakistan, Indien (Abb. 3) und Nepal bis West- und Zentralchina und der Mongolei sowie Korea und Japan. Eine Ausnahme bilden die Steinadler auf Kamtschatka, welche trotz nördlicher Verbrei-
Tab. 1 Die Vertreter der Gattung Aquila bilden eine monophyletische Gruppe. Dieser Einteilung liegen neue Erkenntnisse über genetische Distanzen bei nuklearer und mitochondrialer DNA zwischen den Arten zugrunde (nach Lerner et al. 2016; in Klammern sind die Naturforscher aufgeführt, welche die Art erstmals taxonomisch beschrieben).

tung sehr dunkel sind. In Nordamerika unterscheidet Fischer (1995) eine hellere Form im Norden von einer dunkleren im Süden.
Die hier aufgeführte aktuelle Einteilung in sechs Unterarten (Abb. 4) basiert auf der bereits durch Carl von Linné (1758) und dem Russen Alexei Sewerzov (1888) zurückgehende Taxonomie, ist aber – mit Aussicht auf immer feiner werdende genetische Analysen – als nicht abschließend zu betrachten. Es lässt sich eine westliche und eine östliche Formengruppe unterscheiden:
Westpaläarktische Gruppe:
• Aquila chrysaetos chrysaetos (Nominatform; Linné 1758): Relativ große, eher helle Form. Verbreitung: Europa ohne Iberische Halbinsel, Westsibirien.
• Aquila chrysaetos homeyeri (Sewerzov 1888): Etwas kleiner und dunkler als die Nominatform. Verbreitung: Südlich an Nominatform anschließend; Nordafrika, Iberische Halbinsel, Kleinasien, Kaukasus, Arabische Halbinsel, von dort bis in den Iran.
Ostpaläarktische und nearktische Gruppe:
Abb. 3 Immatures Steinadler-Männchen der Unterart daphanea, aufgenommen in Ladakh. Aquila chrysaetos daphanea ist die größte Unterart und etwas dunkler gefärbt als die Nominatform (H. Haller, 19.02.2023).
• Aquila chrysaetos daphanea (Sewerzov 1888; Abb. 3): Noch dunkler als A. c. homeyeri, größte Unterart. Verbreitung: vom Osten des Iran über Afghanistan, Pakistan, Nordindien und Nepal bis West- und Zentralchina und die Mongolei.
Im Alter von etwa 15 bis 20 Jahren geht die Vitalität von Steinadlern allmählich zurück. Das äußert sich in nachlassender Agilität und Spannkraft, was sich insbesondere bei konkurrenzbedingten Auseinandersetzungen mit Artgenossen bemerkbar macht. Dieser Nachteil kann durch zunehmende Erfahrung und Revierkenntnisse teilweise wettgemacht werden. Alterserscheinungen zeigen sich aber auch äußerlich sichtbar an einigen Körpermerkmalen. Die bei jugendlichen Steinadlern auffallend gelben Hautpartien am Schnabel (Wachshaut) verblassen langsam und werden ungefähr ab dem 15. Lebensjahr deutlich fahler und schließlich gräulich. Der Schnabelwinkel (Lippen), welcher die
Schnabelöffnung säumt, verliert an Volumen, wird dünn und ist nur noch schwach angedeutet vorhanden. Ähnliche Verfärbungen finden auch an den Fängen statt (Abb.12). Deren ehemals gelb-orange Farbe wird langsam gräulich und stellenweise –durch altersbedingte, relativ häufig vorkommende Entzündungen (teils durch Verletzungen) – auch rötlich. Da bei Vögeln keine Strukturen wie Zähne existieren, welche lebenslänglich abgenutzt werden, lässt sich das Alter bei betagten Steinadlern nur anhand solcher Hautveränderungen am Schnabel und an den Fängen abschätzen. Die Krallen und der Schnabel des Steinadlers bestehen genauso wie die Federn aus Keratin (Hornmaterial). Sie

erneuern sich ständig. Dazu bildet sich unter der alten eine neue Kralle bzw. unter dem alten ein neuer Schnabel, der die alte, darüberliegende Schicht systematisch abblättern lässt. Dieser Vorgang kommt mit fortgeschrittenem Alter aus dem Rhythmus und kann weitere Hinweise auf eine Alterseinschätzung liefern. Es braucht dann eine Gesamtbetrachtung des Vogels aus der Nähe unter Einbezug der oben erwähnten Veränderungen der Hautpartien, um eine grobe Altersschätzung vornehmen zu können. Genaue Angaben zum Alter wild lebender, betagter Steinadler sind nur anhand der vereinzelten Ringfunde oder in Ausnahmefällen durch kontinuierliches individuelles Beobachten möglich. Das so belegte Maximalalter liegt bei mindestens 30 Jahren in der Schweiz (Haller 1996) und 37 Jahren in Europa (Abb.11; Fransson et al. 2023). Gefangenschaftsvögel können aber wesentlich älter werden, bis zu 57 Jahre sind nachgewiesen worden (Glutz von Blotzheim et al. 1971). Die mittlere Lebenserwartung liegt allerdings viel tiefer, da insbesondere unverpaarte Jungadler oft vor dem Erreichen der Geschlechtsreife umkommen. Einmal adult und verpaart, beträgt die Verweildauer eines Steinadlers in einem Revier aber durchschnittlich mindestens 11 Jahre (Haller 1996). Über 20-jährige Steinadler werden heute vermehrt von jüngeren Vögeln aus ihrem Revier verjagt und ersetzt. Für solche Vögel sinkt die Überlebensrate dann rapide.

Abb.11 Linke Seite: Der älteste bekannte und wild lebende Steinadler Europas lebte bis im Sommer 2024 in Südschweden. Das abgebildete beringte Weibchen erreichte ein Alter von 37 Jahren (R. Nordquist, 01.04.2023, Skåne).
Abb.12 Vernarbte, zerfurchte und rötliche Fänge (oben: mind. 30 Jahre altes Weibchen des Paars Varen VS) oder solche mit fehlenden Krallen (unten) sind deutliche Hinweise auf ein hohes Lebensalter. Diese Steinadler dürften mehr als 20-jährig gewesen sein (S. Denis).

juvenil
Gefieder der 1. Generation.
Alter: bis 1 Jahr
Mögliche Abweichungen vom Normalfall:
Einzelne Federn der 2. Generation (selten). Oft nur dann, wenn Federn der 1. Generation ausgerissen oder krankheitshalber (vor Wachstumsende) vermausert wurden.

immatur 1
Gefieder der 1. und 2. Generation Alter: 1–2 Jahre
Mögliche Abweichungen vom Normalfall: Es sind ausschließlich Federn der 1. Generation vorhanden (selten, Federn sind stark abgetragen und zerschlissen).

immatur 2
Gefieder der 1., 2. und 3. Generation (die weißen Zonen in den Schwingen und im Stoß werden durch die Federn der 3. Generation durchbrochen); Alter: 2–3 Jahre
Mögliche Abweichungen vom Normalfall:
a) Es sind ausschließlich Federn der 1. und 2. Generation vorhanden (stark abgetragen und zerschlissen).
b) Es sind ausschließlich Federn der 2. und 3. Generation vorhanden (auch innere Armschwingen der 1. Generation sind vermausert).
subadult 1
Gefieder der 2., 3. und 4. Generation Alter: 3–4 Jahre
Mögliche Abweichungen vom Normalfall: Wenige Federn der 1. Generation sind noch vorhanden (innere Armschwingen, seltener Stoßfedern).


Tab. 2 Altersklassen, Alter und Stand der Gefiederentwicklung beim Steinadler. Ergänzend sind häufige bis seltene Abweichungen vom Normalfall aufgeführt (Fotos: S. Denis).
subadult 2
Gefieder der 3. und 4. Generation, keine Federn der 2. Generation.
Alter: 4–5 Jahre
Mögliche Abweichungen vom Normalfall:
Wenige Federn der 2. Generation sind noch vorhanden (innere Armschwingen, seltener Stoßfedern und Handschwingen).

adult 1
Gefieder der 4. und 5. Generation
Alter: 5–8 Jahre
Mögliche Abweichungen vom Normalfall:
a) Wenige Armschwingen und Stoßfedern der 3. Generation sind noch vorhanden (mittlere und innere Armschwingen).
b) Einige Federn der 6. Generation sind vorhanden (innere Handschwingen, Stoßfedern).
adult 2
Alle Großfedern der 5. Generation und mehr
Alter: über 8 Jahre
Mögliche Abweichungen vom Normalfall:
Wenige Armschwingen und Stoßfedern der 4. Generation sind noch vorhanden (abgetragen und zerschlissen).


adult 3
Alle Großfedern der 10. Generation und mehr
Alter: 20 Jahre und älter
Als Gesamterscheinung zu betrachten. Meistens strukturreiche, variable Gefiederzeichnungen. Fahle Hautpartien (Wachshaut beim Schnabel, Fänge), Missbildungen im Großgefieder, am Schnabel und an den Krallen.

Nachfolgende Doppelseite In den Zentralalpen bewohnen Steinadler halboffene Habitate auf der subalpinen und der alpinen Höhenstufe. Hier finden sie Nahrung in Form von wild lebenden Huftieren und Murmeltieren und Nistplätze in Felsen oder auf Bäumen (R. Salis, 12.07.2019, Albulatal GR).

Konkurrenz mit anderen Adlerarten –auch ein Grund für Verbreitungslücken
Die Verbreitung von Steinadlern hängt zu guter Letzt auch davon ab, ob konkurrierende Arten mit ähnlichen Habitat-Ansprüchen vorkommen oder nicht. Die am nächsten verwandten Aquila-Arten dürften hierbei die Hauptrolle spielen und sind vermutlich dafür verantwortlich, dass die südliche Hemisphäre, insbesondere Afrika, von Steinadlern nicht besiedelt worden ist (mit Ausnahme einer knapp nördlich des Äquators liegenden, äthiopischen Kleinpopulation im dortigen Hochland). Hier leben nicht weniger als fünf andere Aquila-Arten mit teilweise ähnlichen ökologischen Ansprüchen: A. africana, A. fasciata, A. spilogaster, A. rapax und A. verreauxii, der Klippenadler. Letzterer nimmt vorab im südlichen Afrika eine mit dem Steinadler eng vergleichbare ökologische Position ein (Abb. 8). Die eine Art würde die andere wohl verdrängen. In asiatischen und osteuropäischen Arealteilen des Steinadlers treten zudem der Schreiadler Clanga pomarina, der Schelladler Clanga clanga, der Zwergadler Hieraetus pennatus, der Steppenadler A. nipalensis und der Östliche Kaiseradler (A. heliaca) auf. Steinadler überlagern hier teilweise die Arealteile der andern Adlerarten und kommen wohl daher nicht so großflächig verbreitet wie in Nordamerika vor, wo neben dem Steinadler keine andern Aquila-Arten existieren. Deutlich tritt dies in den Balkanländern zutage, wo auch
Schreiadler, Zwergadler und Habichtsadler brüten und Steinadler nur punktuell auftreten. Auch andere Greifvögel inklusive Geier können Steinadler konkurrenzieren, allerdings ohne dass sie eine Koexistenz wesentlich beeinträchtigen oder gar verhindern würden. Dazu gehört auch der Bartgeier. Seine Existenz limitiert zwar nicht dessen Vorkommen, Konkurrenzeffekte könnten aber eine Rolle für ausgedünnte Bestände spielen. Dazu mehr in Kapitel 5.
Werfen wir nun einen etwas genaueren Blick auf die aktuelle Verbreitung des Steinadlers in der Schweiz.
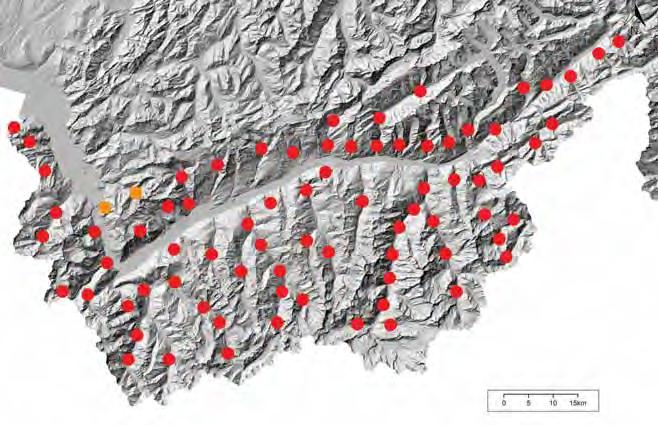
Abb. 9 Steinadlerreviere in der Schweiz 2024 (vgl. Knaus et al. 2018, aktualisiert). Reviergrenzen gemäß Feldbeobachtungen, topografischen Vorgaben und Telemetriedaten von Jungadlern im Bettelflug. Bei isolierten und am Rand der Population liegenden Territorien sind die Reviergrenzen unklar (gestrichelte Linien). Seit 1996 neu dazugekommene Reviere sind hellgrün, ältere Reviere dunkelgrün. Ein einziges Territorium verwaiste im Verlauf der letzten zwei Jahrzehnte (rot). (Quelle: Schweizerische Vogelwarte Sempach; Basiskarte: swisstopo).
Abb. 10 Rechte Seite: Steinadler-Lebensräume in den Alpen zeichnen sich durch ausgedehnte alpine Flächen aus. Brutplätze liegen meist im oberen Bereich des Waldgürtels. Die Aufnahme zeigt die Winterlandschaft im Oberengadin mit den Dörfern S-chanf und Zuoz sowie dem Talfluss Inn. Das Blickfeld umfasst den Lebensraum von fünf Steinadlerpaaren. (D. Jenny, 26.12.2021)
In der Schweiz lebt 98 % des Steinadlerbestands in den Alpen
Das heutige Vorkommen des Steinadlers in der Schweiz umfasst den Alpenraum und wenige Brutpaare im Bereich der Voralpen und im Jura (Abb. 9). Die Schweizer Alpen sind die höchste Bergkette Mitteleuropas und machen rund 60 % der Landesfläche aus (Abb. 10). Sie umfassen 48 Gipfel mit über 4000 m Höhe, örtlich noch große Gletscher und eine markante, Ost-West verlaufende Gebirgsfurche, die sich vom Rhonetal VS bis zum Vorderrheintal GR erstreckt. Über 60 % des Geländes liegt über der Baumgrenze. Diese Flächen bilden die wichtigsten Jagdgebiete und damit einen wesentlichen Teil der Lebensräume für Steinadler. 98 % der Steinadler in der Schweiz leben gegenwärtig in den Alpen, deren alpine Flächen heute vollständig mit Steinadlerrevieren abgedeckt sind. Im Süden erreicht die Schweiz den Alpenrand einzig im südlichsten Tessin, wo südlich des Luganersees grenzübergreifend zu Italien ein Brutpaar ansässig ist. Nur dort, wo großflächig vergletscherte Gebiete wie in den Berner und Walliser Hochalpen vorkommen, gibt es innerhalb der Alpen Verbreitungslücken. Dank heute schweizweit guter Kenntnisse der Steinadlervorkommen können wir die Verbreitungsgrenzen und Bestandsverhältnisse recht präzise darstellen. Die Fehlergrenze für die Bestandsangabe dürfte weniger als 5 % betragen.
Die Verteilung der Revierpaare zeigt eindrücklich, wie homogen Steinadler heute im schweizerischen Alpenraum verbreitet sind. Die gut 370 Territorien in den Alpen verteilen sich auf knapp 25 000 km2 (im Mittel 1,4 Paare pro 100 km2). Dennoch gibt es in Teilregionen Unterschiede in der Populationsdichte. Diese schwankt zwischen 0,9 und 2,5 Paaren pro 100 km2 (Jenny et al. 2024). Besonders dicht besiedelt sind Regionen im Unter-
engadin in der östlichsten Ecke der Schweiz, im Grenzgebiet der Kantone St. Gallen, Graubünden und Glarus und im Oberwallis. Diese Unterschiede ließen sich bisher nicht durch die Ressourcen- oder Habitatqualität in den Regionen erklären. Sie scheinen vielmehr mit topografischen oder auch innerartlichen, sozialen Faktoren zu tun zu haben, die noch nicht im Detail verstanden sind. Heute liegt die alpine Steinadlerpopulation im Bereich der Kapazitätsgrenze des Lebensraums, was allerdings nicht ausschließt, dass sich weiterhin neue Paare zwischen den bestehenden Territorien einzwängen und sich die Bestandsverdichtung fortsetzt (vgl. Kap. 7).
Außerhalb der Alpen siedeln Steinadler in der Schweiz nur in kleiner Zahl. Im hügeligen nördlichen Alpenvorland, das zum Mittelland gehört, leben derzeit vier Paare. Im Jura haben bis 2024 innerhalb der Schweiz fünf Paare gebrütet (Abb. 9). Dazu kommen Hinweise auf mindestens 1–2 weitere anwesende Paare.
Der im Norden der Schweiz liegende halbmondförmige Gebirgszug des Jura besteht aus Kalkgestein und weist typische aufgefaltete Höhenzüge bis knapp über 1600 m ü. M. auf. Die Landschaft ist geprägt durch bewaldete Hügelketten, ausgedehnte Kulturlandflächen in den flachen Zonen zwischen den Höhenzügen, Wiesen und Weiden in höheren Lagen (Abb. 11) und weit gestreute kleinere und mittelgroße Siedlungen. Für den Steinadler bieten die wenig intensiv genutzten Wiesen und Weiden und halboffenen Waldrandgebiete in Lagen über 1000 m ü. M. relativ gute Jagdbedingungen. Felsen unterschied-















beiden Strategien wechseln. Das macht Steinadler anpassungsfähig und ist mit ein Grund für seine weite Verbreitung. Ein weiteres Ernährungsmerkmal ist seine Flexibilität bezüglich Beutetieren. Diese haben nur wenige Grundvoraussetzungen zu erfüllen: sie müssen eine gewisse Größe haben und aus der Luft oder vom Ansitz aus geortet werden können. Das gilt auch für Kadaver.
Steinadler auf der Jagd – als Jungadler unbeholfen, später entschlossen und effizient
Abb.3 Linke Seite: Diesjähriger Jungadler bei unbeholfen wirkender Attacke auf einen Rotfuchs. Dieser bleibt relativ gelassen und macht dadurch deutlich, dass keine akute Gefahr besteht.
Abb.4 Während der Aufzuchtphase bearbeiten die Reviervögel ihre Beute – hier ein Murmeltier – vor dem Eintrag in den Horst oft auf vorgelagerten Felswarten. (Fotofallenaufnahme D. Jenny, 29.04.2024, Tschierv GR).
Das Schlagen von Beutetieren bis zur Größe eines Rehes liegt dem Steinadler gleichsam im Blut. Damit ist gemeint, dass ein genetisch vorgegebener Rahmen, früher oft Instinkt genannt, dafür sorgt, dass ein Beuteschlagverhalten ausgelöst wird, wenn bestimmte Reize auftreten. Das tönt nach einem Automatismus, ist aber in der Realität weit davon entfernt. Denn Erfahrung, individuelle Unterschiede und das Zusammenspiel von innerer Motivation und äußeren Reizen machen die Sache komplex und lassen in jedem Momentum einer Jagdszene Spielraum zu. Diese wird durch Lernerfahrungen gefüllt, welche es dem jagenden Steinadler ermöglicht, Beutetiere stetig effizienter zu jagen. Wer schon einmal erfahrene Steinadler beim Beuteschlag beobachten konnte, weiß was damit gemeint ist. Man spürt im Vorfeld der Szene eine kompromisslose Entschlossenheit, gefolgt von einem oft atemberaubenden Stoßflug mit anschließendem Zupacken (Abb. 2). Da gibt es kein Zögern.

von 12 km2 (Revier Susauna2) bis 113 km2 (Revier Bernina). Im Wallis konnte Serge Denis die Verkleinerung eines Reviers im Verlauf von fast 40 Jahren an einem Paar im Rhonetal exemplarisch aufzeigen (Abb. 3). Bei den Paaren im Mittelland und im Jura sind die Reviere größer, sie umfassen etwa 100 km2. Da es dort aber bis heute keine unmittelbar angrenzenden Revierpaare gibt, sind die Reviergrenzen diffus und der Verteidigungsaufwand bleibt relativ klein.
Überwachen, attackieren und verfolgen
Wie aufwendig und risikoreich die Überwachung und Revierverteidigung für verpaarte Steinadler in den Alpen ist, bzw. bereits in den 1970er-Jahren war, zeigen die von Haller (1982, 1996) erhobenen Daten zum Zeitbudget von Reviervögeln, insbesondere von einem genau untersuchten Paar im Dischmatal bei Davos während der Nestlingszeit im Jahr 1979. Männchen und Weibchen weilten dort während 102 bzw. 76 Stunden Sichtkontakt zu 30 % bzw. 49 % auf insgesamt acht Aussichtswarten, von denen sie das Revier überwachten (Abb. 4). Etwa 20 % der Zeit verbrachten sie fliegend, einerseits für Dislokatio-
nen einschließlich Jagdaktivitäten, andererseits auch um Eindringlinge aus der Höhe zu erspähen und mit Girlandenflügen (vgl. Abb. 11) den Anspruch als Revierbesitzer zu signalisieren. Bei der Etablierung von neuen Adlerpaaren ist der Aufwand für die Revierbesetzung besonders offenkundig: Solche Vögel sind fast ununterbrochen in der Luft und vollführen einen Girlandenflug nach dem andern.
Bei Sichtung von ins Territorium eingedrungenen Fremdadlern reagieren Reviervögel in aller Regel rasch und entschlossen. Sie fliegen auf und stoßen, oft flügelschlagend, pfeilgerade
Abb. 4 Reviervögel verbringen viel Zeit mit der Überwachung ihres Reviers. Meist nutzen sie erhöhte Aussichtswarten mit Einblick in große Teile des Territoriums (Fotofallenaufnahme D. Jenny, 26.04.2024, Tschierv GR).
Abb. 5 Rechte Seite: Ein umherstreifender Einzeladler wird vom ansässigen Revierinhaber des Paars Susauna II heftig attackiert (F. Wehrli, 27.04.2024, S-chanf GR).

Richtung Eindringling. Stoßflüge auf Fremdadler werden gelegentlich mit bis zu zwei Kilometer langen Sturzflügen eingeleitet. Meist werden die Eindringlinge von einem oder beiden Standvögeln in hastigem Schlagflug verfolgt, manchmal kilometerweit (Haller 1996). Die Angriffe erfolgen meist mit ausgefahrenen Fängen, wobei sich der Fremdadler im Abwehrreflex unmittelbar vor dem Zusammentreffen zum Angreifer drehen. Dabei verkrallen sich die Kontrahenten und trudeln nicht selten mitunter sekundenlang ab (Abb. 5). Manchmal kommt es zu Angriffsserien mit bis zu 15-maligem Körperkontakt (Haller 1996).
Jenny (1992) wies im Berner Oberland eine stärkere territoriale Rolle des Männchens im Vergleich zum Weibchen nach. Bei Verhaltenselementen, die mit territorialer Aktivität zu tun haben (gerichtetes Girlandenfliegen, Attackieren oder Verfolgen von Fremdadlern), waren in 301 dokumentierten Fällen mit unterscheidbaren Geschlechtern Männchen fast doppelt so oft beteiligt wie Weibchen (Anhang Tab. 13). Die dominante territoriale Rolle der Männchen äußert sich auch außerhalb der Brutzeit, wenn keine Bindung zu einem Brutplatz besteht. Funktionell lässt sich dies annäherungsweise erklären. Die et-

was kleineren Männchen haben während direkter Auseinandersetzungen mit Artgenossen vermutlich Vorteile aufgrund ihrer höheren Wendigkeit. Bei den attackierten Eindringlingen handelt es sich in den allermeisten Fällen nicht um benachbarte Reviervögel, sondern um unverpaarte, meist juvenile oder immature (69 %), subadulte (10 %) oder seltener adulte (7 %) Einzeladler (Jenny 1992). Der Anteil attackierter Adultvögel hat seit den 1990er-Jahren vermutlich zugenommen. Auch wenn keine aktuellen Daten dazu vorliegen, fiel während der Monitoringbeobachtungen im Engadin ab dem Jahr 2000 auf, dass vermehrt sogenannte adulte Floater auftraten. Das sind überzählige adulte Steinadler ohne Territorium, die sich genauso verhalten wie junge Steinadler während des Dispersals. Wie das in Kapitel 4 beschriebene Beispiel eines aus seinem Revier vertriebenen adulten Weibchens zeigt, werden derlei adulte Floater besonders heftig attackiert: Das Leben des bedauernswerten Vogels endete schließlich als Folge heftiger Auseinandersetzungen mit Revieradlern (Jenny & Fischer 2023).
Attacken gegen Fremdadler haben oft Verletzungen und nicht selten gar den Tod eines oder beider Kontrahenten zur


Sommer
Winter
Abb. 27 Linke Seite: In den winterlichen Einzeladlergebieten sind nicht selten drei oder sogar mehr immature Steinadler zusammen anzutreffen. Sie nutzen meist Lawinen zum Opfer gefallene Huftiere und zeigen als Aasfresser eine geierartige Lebensweise. Auch andere Arten, etwa Kolkraben, Elstern oder Bartgeier, werden von Aas angelockt.
Abb. 28 Mittels Peildaten von besenderten Jungvögeln identifizierte sommerliche Jugend-home-ranges im östlichen Graubünden 2018 bis 2023 (rot eingekreist). Die Datenpunkte repräsentieren Fressverhalten, das mittels Beschleunigungssensoren definiert wird. Die schwarzen Punkte sind die Revierzentren der ansässigen Steinadlerpaare. Die Jugend-homeranges liegen abseits der Revierzentren. (Daten aus: Steinadlerprojekt über Jungadler, Schweizerische Vogelwarte Sempach (Julia Hatzl) und Max-Planck-Institut für Verhaltensbiologie, Radolfzell).
dessen Territorium die attraktiven Südhänge bei Guarda umfasst – für Einzeladler ist es dort gefährlich geworden. Vorweggenommen sei hier noch eine Auswirkung auf den Bruterfolg dieses neuen Paars: Es hat mit 0,21 Jungvögeln/Jahr eine der tiefsten Nachwuchsraten im Engadin und im Jahr 2009 letztmals erfolgreich gebrütet. Das ist der Preis, den die Reviervögel bezahlen, wenn sie ein attraktives Gebiet von Einzeladlern freihalten müssen.
Sommerliche Einzeladlergebiete sind Jugend-home-ranges
Dank der umfassenden GPS-Daten kommt heute eine weitere, bisher kaum bekannte Erkenntnis dazu. Jungadler belegen nämlich im Sommer anhaltend Einzeladlergebiete, die wir als Jugend-home ranges bezeichnen. Das sind 30–80 km2 große Flächen, die – wie das bereits erwähnte Gebiet bei Tamangur – in der Regel weit entfernt von den nächsten Brutplätzen liegen. Hier halten sich zwischen Mai und Oktober zeitweise immer wieder die gleichen Jungadler auf. In den Wintermonaten löst sich diese räumliche Treue auf, die Jungadler streifen dann auf der Suche nach Tierkadavern in tieferen Lagen wieder weit he -
Die Eiablage erfolgt in der Schweiz meist zwischen Mitte März und Anfang April. Im Engadin begann die Legeperiode in den Jahren 2000 bis 2024 in zwei Dritteln aller Fälle zwischen 27. März und 10. April (Abb. 27), mit einem mittleren Legedatum am 29. März. Frühestes Legedatum war der 15. März und das späteste der 13. April. Auch in anderen Teilen der Alpen, im Mittelland und im Jura dürften die Legeperioden ähnlich liegen. Es lassen sich bisher keinerlei saisonale Verschiebungen der Legebeginne erkennen. Haller (1996) verglich Daten aus Graubünden zwischen 1965–1979 und 1980–1994, erkannte aber keine Veränderungen, und dies gilt auch für die aktuelle Stichprobe aus dem Engadin. Hingegen unterscheiden sich die festgestellten einheimischen Legeperioden teilweise erheblich von jenen in nordamerikanischen oder mediterranen und afrikanischen Populationen. Die extremsten Abweichungen beziehen sich auf den Yukon in Kanada mit dem mittlerem Legedatum am 1. Mai (Mossop et al. 1986) sowie auf eine Eiablage am 11. November in der Sahara in Niger (Clouet & Goar 2004). Klimatische Bedingungen, abhängig von der geografischen Breite, beeinflussen die Saisonalität der Brutperiode maßgeblich. Inwiefern beim weit verbreiteten Steinadler genetische Vorgaben oder phänotypische Anpassungen das Timing des Brütens mitbestimmen, muss offen bleiben. Vermutlich sind beide Faktoren wirksam. Was durch langjährige Erfahrung bei Brutkontrollen auffällt, sind erhebliche individuelle, von den einzelnen Paaren abhängige Unterschiede. Gewisse Paare scheinen traditionell frühe Brüter zu sein, andere hingegen beginnen regelmäßig spät mit dem Brutgeschäft. Hervorzuheben ist etwa das Paar Il Fuorn GR, das schon um den 20. März mit Brüten beginnt oder – als Spätbrüter – das Paar Bernina GR, dessen Jungvögel nicht vor Anfang August ausfliegen. Das mag mit den Präferenzen der einzelnen Brutpartner zu tun haben und hängt wohl auch mit deren Erfahrung zusammen. Untersuchungen beim Bartgeier haben jedenfalls ergeben, dass mit dem Lebensalter und der Erfahrung von Brutvögeln die Brutperiode stetig früher beginnt (Jenny 2016). Bei Partnerwechseln können derlei Traditionen durchbrochen werden. Tatsächlich sind abrupte Änderungen bezüglich Brutbeginn bei Paaren ein Hinweis darauf, dass neue Partner aufgetreten sind. Meist verschiebt sich das Legedatum dann nach hinten, weil oft jüngere Partner den neuen Platz einnehmen.
Die Bebrütung von Eiern (Abb. 28) mit einer Wärmeversorgung des heranwachsenden Embryos von außerhalb des Körpers der Eltern ist ein Merkmal der Vögel. Die Eitemperatur
August
Juli
Pentaden
24.8.–28.8.
19.8.–23.8.
4.8.–8.8. 9.8.–13.8. 14.8.–18.8.
25.7.–29.7. 30.7.–3.8.
5.7.–9.7. 10.7.–14.7. 15.7.–19.7. 20.7.–24.7.
25.6.–29.6. 30.6.–4.7
Juni
Ausfliegen 143
26.5.–30.5. 31.5.–4.6. 5.6.–9.6. 10.6.–14.6. 15.6.–19.6. 20.6.–24.6.
Mai
April
März 7.3.–11.3. 12.3.–16.3. 17.3.–21.3. 22.3.–26.3. 27.3.–31.3. 1.4.–5.4. 6.4.–10.4. 11.4.–15.4. 16.4.–20.4. 21.4.–25.4. 26.4.–30.4. 1.5.–5.5. 6.5.–10.5. 11.5.–15.5. 16.5.–20.5. 21.5.–25.5.
Schlupf 43
Eiablage 49
0510152025303540
Abb. 27 Verteilung des Legedatums, des Schlupftermins und des Zeitpunkts beim Ausfliegen der Jungvögel über die Pentaden in den Monaten März bis August bei Steinadlerpaaren im Engadin zwischen 2000 und 2024. Die Ziffern bezeichnen die Anzahl berücksichtigter Ereignisse (D. Jenny, unpubl. Daten).
Abb. 28 Rechte Seite: Brütende Reviervögel verharren stundenlang fast unbeweglich auf ihrem Gelege. Wind und Wetter oder gar Schneefall scheinen dem Brutgeschäft wenig anhaben zu können. Auf Störungen reagieren die Brutvögel hingegen meist mit Nervosität oder gar Wegfliegen vom Nest.


sollte dabei möglichst konstant bleiben. Auch Schutz und Verhinderung von Überhitzung der Eier und die Regulierung der Feuchtigkeit müssen gewährleistet sein. Bei Greifvögeln im Allgemeinen und dem Steinadler im Speziellen dauert diese Periode – bedingt durch deren relativ große Körper – überdurchschnittlich lang. Die Periode bis zum Schlüpfen des ersten Nestlings umfasst 41 bis 45 Tage (Watson 2010). Meist sind es aber erstaunlich konstante 42 Tage. Etwas länger dauert es, wenn bei einem Zweiergelege nur das zweite Ei befruchtet ist. Die Eitemperatur beim Steinadler entspricht in etwa der Körpertemperatur und liegt bei rund 40 oC.


Ablösungen beim Brutgeschäft –das Weibchen dominiert
Die Partner lösen sich beim Brutgeschäft ab, wobei das Weibchen den größten Teil übernimmt und nachts sogar ausschließlich brütet. Die intensiven Untersuchungen mittels SenderEiern, automatischen Kameras und Direktüberwachung im Berner Oberland (Jenny 1992) ergaben folgende Anteile an der Bebrütung während des Tages: Weibchen 71 %, Männchen 18 % (582 Stunden, verteilt auf 19 Bruten bei 10 Paaren, 1987–1990). Collopy (1984) kam in Nordamerika auf ähnliche Anteile (Weibchen 83 % und Männchen 14 %), während Bassi (2024) in Norditalien höhere Anteile beim Männchen dokumentierte
0,45 bzw. 0,36 Jungvögel pro Paar und Jahr aus Jenny et al. (2024) und seit 2020 setzte sich der Rückgang der Nachwuchsrate weiter fort, auf aktuell 0,28 bis im Jahr 2024. Dies ist im Vergleich zu 36 andern Steinadlerstudien in Europa, die Ellis et al. (2024) in ihrem umfangreichen Steinadlerbuch zusammenstellen, der tiefste bekannte Wert überhaupt. Solche Vergleiche sind allerdings mit Vorsicht aufzunehmen, denn nicht immer wird in den Vergleichsstudien klar, inwiefern auch nichtbrütende Paare in die Berechnungen mit einbezogen wurden. Sie bestätigen aber zweifellos die heute sehr tiefen Reproduktionszahlen im Alpenraum ganz allgemein und in den Zentralalpen im Besonderen. Diese tiefen Nachwuchsraten können aber mit einer gewissen Gelassenheit zur Kenntnis genommen werden, denn es gibt eine bemerkenswerte Feststellung: die Population wächst auch heute noch, wenn auch nur leicht. Das bedeutet, dass die heute tiefe Produktivität immer noch ausreicht, um Überschüsse zu erzielen, oder mit anderen Worten: Die Überlebensraten der Steinadler sind erstaunlich hoch, wohl wesentlich höher als bisher angenommen (Anhang Abb. 4).
Dass die Werte zur Reproduktion früher deutlich höher waren, belegen u .a. historische Texte, etwa vom legendären Wildhüter Andrea Rauch, der bei einem Adlerpaar aus Pontresina lange Fortpflanzungsreihen von 23 Jungvögeln in 21 Jahren
Anzahl Reviere linear (Nachwuchsrate) Jahr Nachwuchsrate
aufführte (Rauch 1937); und Stemmler (1955) erwähnte durchgehende Horstbesetzungen am Chlushorn bei Boltigen zwischen 1920 und 1936. Eine solch hohe Produktivität gibt es heute im Alpenraum nicht mehr.
Beim Betrachten der Entwicklungskurve im Verlauf der letzten 50 Jahre im Engadin zeigt sich der abnehmende Trend deutlich (Abb. 39). Etwas aus der Reihe fällt der jüngste Wert im Jahr 2024, mit einem für diese Phase außergewöhnlich hohen Wert von 0,46. Dass es sich wohl um einen Ausreißer handelt, zeigen neuste Befunde zur Brutaktivität aus dem Jahr 2025, welche wiederum auf sehr geringe Nachwuchsraten mit einem rekordhohen Nichtbrüteranteil hindeuten.
Bei näherem Hinsehen fällt neben der starken jährlichen Schwankung auch eine Wellenform der Kurve auf, mit zeitweilig sogar ansteigenden Tendenzen, so von 1995 bis 2006. Derart antizyklische Trends sind typisch für komplex beeinflusste Variablen und sie zeigen auf, wie wichtig langfristige Datenreihen sind, um Megatrends zu erkennen. Das zeigen auch die Daten aus dem Wallis, wo die entsprechenden Datenreihen kürzer sind (Anhang Abb. 12). Hier lässt sich im Verlauf von 20 Jahren kein Trend bei der Nachwuchsrate erkennen, hingegen sind die jährlichen Schwankungen auch hier groß.
Abnehmende Nachwuchsraten zeichnen sich auch im Grenzgebiet der Kantone Bern, Freiburg und Waadt ab, wo ein

Team um den äußerst verdienstvollen Steinadlerspezialisten Gaby Banderet† seit den 1960er-Jahren einen Steinadlerbestand überwacht (Anhang Abb. 13). Ähnlich wie in Graubünden war die Jungenproduktion in den Dekaden vor 1990 generell deutlich höher als heute und erreichte bis 1980 noch Werte von 0,6 und mehr. Die rückläufige Tendenz der Nachwuchsrate, aber auch die jährlichen Schwankungen, sind ein vielerorts belegtes Phänomen in Populationen, die nach Phasen der Verfolgung wieder erstarkt sind. Eine mit dem Populationswachstum einhergehende sinkende Reproduktionsrate, wie sie aus den Abbildungen 39 (und Abb. 13 im Anhang) hervorgeht, lässt sich auch bei anderen langfristig erhobenen Datenreihen zum Bruterfolg im Alpenraum erkennen (Fasce et al.
Abb. 39 Linke Seite: Nachwuchsrate (Anzahl flügge Jungvögel pro anwesendes Paar) im Engadin seit 1975 (violette Linie). Orange hinterlegt ist die Paarzahl, die stetig angewachsen ist. Daten vor dem Jahr 2000 aus Haller (1996) und AJF Graubünden; nach 2000 aus Jenny et al. (2024) mit Ergänzungen bis 2024.
Abb. 40 Verlassenes Einergelege in einem Horst auf einer über den Felsrand herunterhängenden Bergföhre. Die meisten Brutabbrüche fallen in die Bebrütungsphase. Die Gründe bleiben oft unbekannt, haben aber meist mit innerartlichen Konkurrenzeffekten oder menschbedingten Störungen zu tun (D. Jenny, 04.06.1991, Gental BE).
2011, Chambert et al. 2020, Wentworth et al. 2024). Außerhalb der Alpen sind sowohl rückläufige als auch konstante oder zunehmende Trends bekannt. Sie widerspiegeln die Bedingungen, denen die Populationen unterliegen. Dabei spielen natürliche Ressourcen, (menschbedingte) Störungseinflüsse, aber eben auch Populations-Wachstumsprozesse die entscheidenden Rollen. Wenn es um die Erklärung der tiefen und sinkenden Fortpflanzungswerte in den Alpen geht, ist das Populationswachstum und die hohe Paardichte zum dominierenden Aspekt geworden, weil – wie in Kapitel 5 ausgeführt – dichteabhängige Konkurrenzeffekte wirksam sind.
Tiefe Fortpflanzungsraten aufgrund vieler Nichtbrüter Hauptverantwortlich für die heute geringen Nachwuchsraten in den Alpen ist – wie oben beschrieben – ein hoher Anteil an nichtbrütenden Paaren, dies als Folge von dichteabhängigen Effekten (Anhang Abb. 14). Solche sind keineswegs auf den Steinadler beschränkt, sondern sind in der Natur weit verbreitet, wenn auch in unterschiedlicher Ausprägung und nicht überall erkannt. Ein Vergleich mit dem exponentiell wachsenden Bartgeierbestand in Graubünden verdeutlicht dies. Dort liegt die Rate an Nichtbrütern bei sehr geringen 4,1 % (n = 171 Paarjahre, D. Jenny unpubl. Daten), also gut als zehnmal tiefer als beim Steinadler. Dies ermöglicht eine gegenüber dem Steinadler

Haller (1988) zeigte die Arealausweitung im Kanton Bern exemplarisch und belegte dort, dass die Ausbreitung schon vor der Mitte des 20. Jahrhunderts erfolgte (Abb. 4), also noch vor der Unterschutzstellung des Steinadlers im Jahr 1953. Erklärbar ist dies durch die schon zu Beginn des 20. Jahrhunderts rückläufigen Abschusszahlen und die sich langsam erholenden Huftier- und Murmeltierbestände. Im Kanton Bern erstreckt sich die Besiedlung durch den Steinadler über alle drei genannten Landschaftstypen, Alpen, Mittelland und Jura. Hier zeigten sich die Arealvergrößerungen, aber auch die etappenweise Verdichtung der Population seit Ende des 19. Jahrhunderts beispielhaft.
Mit dem 1974 im Raum Buchholterberg neu gegründeten Revier war die Arealausweitung im Kanton Bern zum Mittel-
land hin abgeschlossen (Haller 1988). In anderen peripheren Bereichen der Population erfolgten neue Besiedlungen am Alpenrand und im Mittelland bis in die 1990er-Jahre, danach nicht mehr. Haller (1994) dokumentierte diese Entwicklung im St. Gallischen Alpenvorland, wo sich kurz vor 1980 im Tössbergland und um 1990 im Toggenburg je ein Paar ansiedelte. Ein drittes Mittelland-Paar ließ sich Ende der 1990er-Jahre
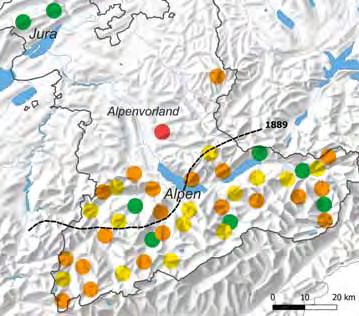
Abb. 3 Eine erste Verbreitungskarte des Steinadlers veröffentlichten Theophil Studer und Victor Fatio 1889 in ihrem Katalog der Schweizerischen Vögel. Das Brutgebiet des Steinadlers ist rot getönt, Einzelnachweise mit roten Punkten vermerkt. Ergänzt wurde diese Karte mit den heutigen (2024) Verbreitungsgrenzen (schwarze Linien). Mit Pfeilen sind die seit 1889 neu besiedelten Flächen angedeutet.
noch weiter nördlich bei Mogelsberg nieder (vgl. Kapitel 3 Abb. 9). Es ist das bisher am weitesten von der Alpenpopulation entfernte Revier. Auch in den südlichen Ausläufern der Alpen, die nur in einem kleinen Zipfel im Südtessin innerhalb der Schweiz liegen, siedeln heute vier vorgelagerte Paare. Im Sotto Ceneri haben sich in den 1990er-Jahren zwei Paare am Monte Tamaro und eines am Monte Generoso niedergelassen (Jenny 1996).
Von Null auf 2000 km2 Fläche in 15 Jahren –die Wiederbesiedlung des Jura
Seit 2009 – nach 150-jähriger Abwesenheit – hat der Steinadler auch im Schweizer Jura als Brutvogel Fuß gefasst (Müller & Volet 2010). Die erste erfolgreiche Brut wurde im Regionalen Naturpark Thal im Solothurner Jura nachgewiesen. Im französischen Teil des Jura kam es schon ab 1994 zur Wiederbesiedlung mit bis anhin vier Brutpaaren (Wentworth et al. 2024). Dort entstand das allererste Revier am Ort, wo sich der Alpenbogen der Jurakette am stärksten annähert – bei Fort de L’Écluse nahe Genf. Auch das erste Jurarevier in der Schweiz bildete sich – wohl kaum zufällig – an der Stelle, welche zum äußersten Paar im Napfgebiet die geringste Distanz aufweist. Der kleine Bestand im Schweizer Jura wuchs zuerst zögerlich, danach schneller, und umfasst heute mindestens fünf, eventuell sechs Paare (Abb. 5). Von weiteren 1-2 Paaren gibt es Hinweise, aber noch keine sicheren Nachweise. Die Arealausweitung erfolgte bisher ausschließlich in Richtung Westen, wo sich in den Kantonen Bern, Neuenburg und Jura schrittweise
neue Paare ansiedelten. Details dazu finden sich in Kapitel 3. Die besiedelte Fläche mit brütenden Paaren weitete sich im Jura innerhalb von 15 Jahren auf fast 2000 km2 aus. Hier besteht noch erhebliches Potenzial für eine weitere Bestandszunahme und Ausdehnung des Brutgebiets. Allerdings lassen die im Vergleich zum Alpenraum weniger guten Voraussetzungen bezüglich Nahrungsangebot, Brutplatzangebot und Störungspotenzial kaum eine so hohe Populationsdichte wie in den Alpen zu. Gegenüber den Bedingungen im alpennahen Mittelland sind die Voraussetzungen im Jura aber eher besser. Im Alpenraum waren die für Revierpaare geeigneten, peripheren Gebiete bereits in den 1980er-Jahren von Steinadlerrevieren weitgehend belegt (Haller 1988, 1996) und einer weiteren Ausbreitung – mit Ausnahme des Jura – scheinen seither
Abb. 4 Links: Veränderungen des Brutareals und des Bestands des Steinadlers in den Berner Alpen, im Alpenvorland und im Berner Jura (ausgezogene Linie = Kantonsgrenze) seit Ende des 19. Jahrhunderts (gestrichelte Linie = Nordgrenze des regelmäßigen Steinadlervorkommens nach Studer & Fatio 1889). Die Punkte zeigen die Revierverteilung vor 1988 (orange und gelb, Haller 1988) und danach bis 2024 (grün). Alte, traditionell bekannte Reviere, die bereits 1920–1940 bestätigt wurden, sind orange dargestellt. Ein Revier ist seit 2005 verwaist (rot). Basiskarte Swisstopo.
Abb. 5 Entwicklung der Anzahl Reviere mit Brutaktivität im Jura. Seit der ersten Brut 2009 wuchs der Bestand stetig und zunehmend bis auf heute 5 oder 6 Revierpaare. Weitere 1–2 Paare werden vermutet (Grundlage: Datenbank der Schweizerischen Vogelwarte Sempach und A. Bassin).






Abb.10 Raumbelegung der Paare im mittleren Engadin in den Jahren 1975 (oben) und 2024 (unten). Neue Paare sind rot beschriftet. Die Revierzahl hat sich in 50 Jahren fast verdoppelt. Datengrundlage: Haller (1996) und D. Jenny (unpubl. Daten, Schweizerische Vogelwarte Sempach und Amt für Jagd und Fischerei Graubünden). 1975 2014
Etwa ein Fünftel der Schweizer Steinadler lebt heute im 5224km2 großen Kanton Wallis. Zwischen 1910 und 1950 waren im Wallis 23 besetzte Steinadlerreviere bekannt (S. Denis). Systematisch erhobene Angaben zum kantonalen Bestand gibt es seit den Erhebungen von Pierre-Alain Oggier in den 1990er-Jahren (Oggier 1994). Damals wurden 57 Revierpaare nachgewiesen. Davon ausgehend lässt sich die Bestandsentwicklung bis heute herleiten.
Während der letzten drei Dekaden verdichtete sich der Bestand stetig. Die neuen Paare rekrutierten sich auffallend oft aus noch
Abb.11 Verteilung der Revierpaare im Kanton Wallis 2024 (Erhebungen S. Denis).
Zwei im Kanton Waadt brütende Paare (Pont de Nant und Lavey) befliegen große Teile des Kantons Wallis und wurden auf dieser Karte mitberücksichtigt (orange Punkte). Basiskarte: swisstopo.
jungen Individuen. Diese ließen sich zuerst in den größeren Seitentälern, später auch in kleinen Tälern nieder. In besonders geeigneten Teilgebieten wie im Mattertal wuchs die Revierzahl im Verlauf der letzten 30 Jahre von vier auf heute sieben an. Auffallend kleine, nur etwa 20km2 umfassende Reviere wurden erstmals 2011 in der Val Ferret festgestellt. Später schien dies auch in anderen Teilen des Wallis bei neuen Paaren die Regel zu werden. Der Trend gipfelte in einem 2016 neu gegründeten nur gerade 8km2 großen Revier oberhalb Fully, dessen Paar auf Anhieb erfolgreich brütete (Denis 2021). In derselben Region entstand im Jahr 2020 nochmals ein weiteres erfolgreiches Minirevier (15km2). Weitere, aber noch nicht definitiv bestätigte Paare werden bei Liddes, in der hinteren Val Ferret und bei Vissoie vermutet. Den aktuell 75 Walliser Revierpaaren (Abb.11) stehen durchschnittlich je 69,5km2 Fläche zur Verfügung. Stellt man die für Steinadler nicht nutzbaren Gletscherflächen und Hochgebirgslagen in Abzug, sind es noch etwa 57km2 pro Paar.
Vorhergehende Doppelseite Ein adultes SteinadlerWeibchen, das sich den rechten Flügel brach, erhält nach vier Wochen auf der Pflegestation von Werner Fischer Flugtraining zur Stärkung der Flugmuskulatur (D. Jenny, 01.10.2020, Ftan GR).
Obwohl in den meisten europäischen Ländern die Steinadlerbestände heute wachsen oder zumindest stabil sind, bleibt dieser Spitzenprädator – bedingt durch seine naturbedingte Seltenheit – verletzlich. Im Alpenraum haben die Populationen mittlerweile den Bereich der Kapazität ihrer Lebensräume erreicht oder sind auf dem Weg hierzu. Große Beutegreifer entwickeln stets nur eine vergleichsweise geringe Individuenzahl, bei welcher Verluste nicht so leicht kompensiert werden können. Dies steht im Gegensatz zu manch andern Vogel- oder Säugetierarten, die auf einer tieferen trophischen Stufe stehen, deren Raumansprüche kleiner sind und die deswegen größere Bestände zu bilden vermögen.
Der Status der Population, das heißt, ob diese wächst, stabil ist oder sinkt, lässt sich grob durch drei Faktoren erklären: die Produktivität, die Mortalität und die Zu- bzw. Abwanderung. Letzteres ist beim Alpensteinadler praktisch vernachlässigbar, da er ganzjährig sesshaft ist und – bedingt durch Philopatrie (Kasten Seite 211) – eine eher geringe Neigung hat, auszuwandern und entfernte Lebensräume zu besiedeln. Über die Fortpflanzung und deren Erfolg wissen wir heute mindestens aus den Untersuchungsgebieten gut Bescheid. Größere Wissenslücken gibt es hingegen nach wie vor bei Fragen zur Sterblichkeit der Steinadler. Gemeint sind Fakten zu den Sterbe- bzw. Überlebensraten, welche zusammen mit den Fortpflanzungsraten ein modellhaftes Verständnis der Populationsentwicklung ermöglichen. Wir erkennen zwar, ob eine Population zunimmt oder schrumpft, das Zusammenspiel von Nachwuchs und Sterblichkeit kennen wir aber nicht genau. Und wir wissen nicht, bei welchen Veränderungen dieser Werte ein Populationstrend kippt. Bei Arten mit geringer Individuenzahl ist diese Balance labil, also wenig resilient gegenüber neuen Einflüssen. Und derlei neue Einflüsse sind – menschbedingt –heute häufig und sie nehmen tendenziell zu.
Die Sterberisiken des Steinadlers haben sich im Verlauf von gut 100 Jahren drastisch verändert. War es damals die direkte Verfolgung durch Abschüsse und Aushorstungen, so stehen heute – neben den erwähnten innerartlichen Kämpfen – Kolli-

sionen mit Leitungen, Verkehrsträgern und Infrastrukturen, Stromschläge und Vergiftungen im Vordergrund. Es sind Auswirkungen der modernen Gesellschaft, die heute bis in die abgelegensten Alpentäler wirken. Die Sterblichkeit der Steinadler war zu Zeiten seiner gezielten Verfolgung, trotz der vielen neuen Sterberisiken, allerdings wesentlich höher als heute. Das geht allein schon aus der Tatsache hervor, dass der Bestand anfangs des 20. Jahrhunderts zusammenbrach und er sich heute nicht nur erholt hat, sondern sich weiter verdichtet. Trotz bemerkenswert geringer Produktivität wächst der Bestand auch heute noch leicht, erklärbar durch hohe Überlebensraten. Diese liegen in unserer Stichprobe von in Graubünden sendermarkierter Adler bei 0,90 pro Jahr während der ersten fünf Lebensjahre seit dem Flüggewerden, wobei die Sterblichkeit im vierten Lebensjahr deutlich erhöht ist (Anhang Abb. 4). Das bedeutet, dass 60 % der insgesamt 39 besenderten Bündner Steinadler die spätestens im Alter von fünf Jahren erreichte Geschlechtsreife erlebten. Verpaarte Adultvögel haben grundsätzlich höhere Überlebensraten, die wir aber aus methodischen Gründen kaum kennen. Insgesamt liegen unsere Werte in den Alpen deutlich höher als in Studien aus Nordamerika, wo die Überlebensraten basierend auf 270 telemetrierten Steinadlern zwischen 0,84 (juvenile), 0,80 (immature) und 0,91 (adulte) lagen (Hunt et al. 2017).
Europa- und weltweit gibt es Dutzende von ökologischen Steinadlerstudien, die sich fast alle auch mit Artenschutz-
fragen befassen. Dort finden sich meist Statistiken zur Mortalität und deren Ursachen und daraus abgeleitete Maßnahmen. Auch wir machen diese Erhebungen und führen Buch über tot oder verletzt gefundene Steinadler. Es handelt sich dabei insbesondere um Totfunde aus den Kantonen Graubünden und Wallis, aber auch aus anderen Teilen der Schweiz. In Graubünden werden tot gefundene Steinadler systematisch durch das kantonale Amt für Jagd und Fischerei erfasst und Untersuchungen zur Ermittlung der Todesursachen durchgeführt, Gewebeproben entnommen und wichtige Körpermaße erhoben (Abb. 1). Auch am Institut für Fisch- und Wildtiergesundheit der Universität Bern (FIWI) werden pathologische Untersuchungen an toten Steinadlern durchgeführt. Diese Analysen geben einen recht guten Einblick in die Risiken und Gefahren, welchen Steinadler heute ausgesetzt sind (Tab. 1). Sie bringen zwar hauptsächlich qualitative Ergebnisse zutage, sie ermöglichen es aber, bei den Schutzmaßnahmen die richtigen Prioritäten zu setzen. Und sie zeigen auf, wo es aufgrund von Wissenslücken Forschungsbedarf gibt.
Bevor wir uns den Statistiken zuwenden, sei noch eine wichtige Unterscheidung gemacht. Nämlich diejenige zwischen natürlichen und menschbedingten Todesursachen. Anteilmäßig sind in unserer Stichprobe von tot aufgefundenen Tieren mit bekannter Todesursache jene etwas häufiger, die einer natürlichen To-
Abb. 1 Linke Seite: Tot gefundene Steinadler werden am Amt für Jagd und Fischerei Graubünden (AJF) systematisch untersucht. Neben Vermessungen und Probeentnahmen für toxikologische Analysen stehen Abklärungen zur Todesursache im Vordergrund. Links: Hannes Jenny, AJF; rechts David Jenny (G. Derungs AJF, 10.04.2024).
Tab. 1 Todesursachen bei 170 in der Schweiz zwischen 2004 und 2024 tot oder sterbend gefundenen Steinadlern. 59 % der Funde stammen aus dem Kanton Graubünden. Sie wurden beim Amt für Jagd und Fischerei in Chur untersucht. Datengrundlage für alle andern Funde: Institut für Fisch- und Wildtiergesundheit der Universität Bern, Jagdbehörden der Kantone VS, VD, FR, BE, TI, LU, NW, SZ, UR GL, SG. Menschbedingte Todesursachen sind fett hervorgehoben.
desursache erlagen als jene, die einer menschbedingten Ursache zum Opfer fielen. Dazu sind zwei Dinge anzumerken. Erstens: Beim Vergleich der beiden Kohorten ist von einem systematischen Fehler auszugehen, weil Unfallopfer eher gefunden werden als natürlich gestorbene Steinadler. Zweitens: Der hohe Anteil bei den natürlichen Ursachen geht vor allem auf die große Zahl von Kampfopfern zurück (Anhang Abb 16). Innerartliche Auseinandersetzungen mit Todesfolgen sind heute beim Steinadler in den Alpen das größte Sterberisiko.
Unter Berücksichtigung der erwähnten Begleitumstände umfasst die durch menschliche Einflüsse bedingte Zahl von Opfern knapp die Hälfte aller Fälle mit bekannter Todesursache (45,5 %, n = 134). Verglichen mit aus der Literatur bekannten
Analyse am FIWI in Bern fand sich Carbofuran in dessen Leber. Wie dieser verbotene, äußerst giftige Stoff in den Körper des noch nicht ausgeflogenen Jungvogels gelangte, bleibt rätselhaft. Bedenklich ist auch die Ausbringung von Rodentiziden. Das sind für die Bekämpfung von Nagetieren eingesetzte Blutgerinnungs-Hemmer, auf welche Greifvögel sehr sensitiv reagieren. In der Schweiz ist ein Verbot dieses Giftstoffs in Vorbereitung. Im grenznahen Italien wiesen unsere italienischen Kollegen 2018 und 2022 diesen Stoff bei zwei gestorbenen jungen Steinadlern nach.
Man kommt nicht umhin, zu vermuten, dass wir es bei den wenigen bekannt gewordenen Fällen von Opfern von Pestiziden und Rodentiziden unter den Steinadlern und von Greifvögeln ganz allgemein mit der Spitze eines Eisbergs zu tun haben (Buij et al. 2025). Erst die systematische Untersuchung von großen Stichproben wird uns das volle Ausmaß der Problematik dieser Stoffe für Greifvögel vor Augen führen.
Giftköder gegen Wölfe – ein ökologischer GAU
Da Steinadler in den Alpen gegenüber Pestiziden eher wenig exponiert sind, sind sie durch diese Stoffe grundsätzlich weniger belastet als etwa Rotmilane im intensiv genutzten Kulturland. In Frankreich und Spanien stehen bei den Todesursachen für diesen aasfressenden und jagenden Greifvogel Pestizidvergiftungen deutlich an erster Stelle (Aebischer & Scherler 2021). Aber auch beim Steinadler stehen Vergiftungen in einigen südund osteuropäischen Ländern an erster oder zweiter Stelle bei den Todesursachen, so etwa in Spanien, Griechenland oder Bulgarien (Ellis et al. 2024). Diese gehen oft auf das Auslegen von Giftködern zurück, welche zur illegalen Bekämpfung von Wölfen und anderen großen Beutegreifern ausgelegt werden. Betroffen sind ebenso weitere aasfressende Tierarten, die quasi mitvergiftet werden. Diese Bedrohung wird vermehrt wohl auch unsere Lebensräume betreffen, denn im Zuge der Ausbreitung von Großraubtieren ist zu befürchten, dass vermehrt hochtoxische Stoffe in die Natur ausgebracht werden.
Die zweithäufigste menschbedingte Todesursache des Steinadlers in der Schweiz sind Kollisionen mit technischen Einrichtungen. Es überrascht in Anbetracht des dichten Hochspannungsnetzes in der Schweiz nicht, dass knapp 60 % der Opfer unter solchen Leitungen gefunden wurden (n = 17; Abb. 10).
Aber auch der Aufprall an Trag- oder Zugseilen von Bergbahnen kann schwere Traumata mit tödlichen Verletzungen zur Folge haben. Meist sind es Frakturen an Flügeln oder am

Rumpfskelett oder innere Blutungen – mit fatalen Auswirkungen. Erstaunlich ist, dass fünf bis zehn Zentimeter dicke, eigentlich gut sichtbare Leitungen von Steinadlern offenbar nicht immer wahrgenommen werden. Dazu gibt es zwei mögliche Erklärungen: Bei Nebel oder in dichten Wolken fliegen Steinadler oft mit kurzem «optischen Radar»; Ausweichen gelingt dann nicht immer rechtzeitig. Die zweite Erklärung hat mit der Fluggeschw indigkeit zu tun. Im raschen Stoßflug oder bei Girlandenflügen werden nicht selten mehr als 100 km/h erreicht. Bei schlechten Sichtbedingungen besteht dann ein erhöhtes Kollisionsrisiko. Steinadler sind insbesondere bei Gir-
Abb. 10 Hochspannungsleitungen sind für die meisten Kollisionen von Steinadlern an Kabeln verantwortlich. Dieses subadulte Weibchen erlitt schwere Frakturen (D. Jenny, 14.03.2014, Zernez GR).


landenflügen sozial motiviert, sogar erregt und dadurch wohl etwas weniger vorsichtig. Vermutlich sind deshalb in der Stichprobe der Kollisionsopfer adulte und subadulte Vögel mit 86 % der Fälle stark übervertreten, denn erst in dieser Alterskategorie kommt es zu ausgeprägtem territorialem Verhalten einschließlich Girlandenflügen. Das Anbringen von gut sichtbaren Markierungen an Leitungen und Kabeln in regelmäßigen Abständen ist jedenfalls hilfreich, wurde aber in der Schweiz für den Schutz von Greifvögeln bisher leider nur in wenigen Ausnahmefällen in die Tat umgesetzt.
Abb. 11 Überreste eines Steinadlers und Schäden am Höhenleitwerk eines Segelflugzeugs nach einer Adlerattacke mit Kollisionsfolge im Juli 1975 am Sanetschpass BE (R. Notter).
Abb. 12 Immatures Steinadler-Weibchen mit einer offenen Flügelfraktur nach einer Kollision mit einem Segelflugzeug (D. Jenny, 30.09.2004, Müsella GR).
Kollisionen mit Flugzeugen – oft mit tödlichen Folgen für Steinadler Auch mit Flugzeugen kollidieren Steinadler ab und zu. Interessant ist die Feststellung, dass solche Fälle in den letzten Jahrzehnten zurückgegangen sind, ohne dass eine schlüssige Erklärung dafür vorliegt. Die meisten Kollisionen mit Flugzeugen datieren vor 2004, sind also in der in Tabelle 1 aufgeführten Stichprobe gar nicht enthalten. In jener von Jenny (2010) zusammengestellten Übersicht sind insgesamt 20 Ereignisse dokumentiert. Danach waren in 65 % der Fälle Segelflugzeuge beteiligt. Mindestens zwei Drittel gehen auf Attacken durch Steinadler auf die Tragflächen (Abb. 11), die Pilotenkanzel oder das Leitwerk der Flugzeuge zurück (Anhang Tab. 16). Die Angriffe hatten in mindestens der Hälfte aller Zusammenstöße für die Steinadler tödliche Folgen (Abb. 12). Auch Hängegleiter wurden attackiert, was aber für die Steinadler bisher stets


Für umherstreifende Jungadler wie dieses immature Weibchen bedeutet die Winterzeit viel Nahrung in Form von HuftierKadavern (H. Müller, 11.11.2023, Oberriet VS).



David Jenny, Jahrgang 1959, hat an der Universität Zürich Biologie studiert und an der Universität Bern mit einer Studie über den Steinadler im Berner Oberland promoviert. Die Arbeit erhielt den Volz Preis der Universität Bern. Im Rahmen eines Postdoc-Stipendiums verbrachte er ab 1992 zwei Jahre im Regenwald in der Elfenbeinküste, wo er in einem Camp für Primatologie Leoparden mittels Radiotelemetrie erforschte und anschließend diverse Studien publizierte. Von 1997 bis 2013 unterrichtete er als Biologielehrer an zwei Gymnasien im Engadin und war bis 2023 bei der Schweizerischen Vogelwarte Sempach Regionalkoordinator im Engadin, wo er u. a. Monitoringprojekte über Steinadler und Uhus leitete, Renaturierungsprojekte begleitete und in einem Forschungsprojekt zur Ausbreitungsökologie junger Steinadler in Graubünden als Projektleiter fungierte. Bei der Stiftung Pro Bartgeier ist er seit 1997 zuständig für das Brutpaarmonitoring in Graubünden. Seit 2006 ist er Präsident der Engadiner Naturforschenden Gesellschaft SESN und seit 2023 Vizepräsident der Schutzorganisation Pro Lej da Segl. David Jenny hat zwei erwachsene Söhne und lebt seit 1997 mit seiner Frau Barbara in Zuoz. In seiner Freizeit betreibt er Naturfotografie und Gleitschirmfliegen.

Heinrich Haller, geboren 1954, hat an der Universität Bern Zoologie, Botanik und Geografie studiert und an der Universität Göttingen in Wildbiologie habilitiert. Seine Fachgebiete sind die Gebirgsökologie im Allgemeinen und die Wildtiere der Alpen, insbesondere die großen Beutegreifer, im Speziellen. Er hat 1982 die erste Dissertation zum Steinadler in den Alpen verfasst und sich später unter anderem auch mit dem Luchs, dem Wolf, dem Kolkraben und der Wilderei beschäftigt. Zu den drei letzten Themen sind von ihm Bücher im Haupt Verlag erschienen. Heinrich Haller war von 1996 bis zu seiner Pensionierung 2019 Direktor des Schweizerischen Nationalparks (SNP) und lehrte als außerplanmässiger Professor Gebirgsökologie an der Universität Göttingen. Er ist Vater dreier erwachsener Kinder, Großvater von fünf Enkeln und lebt mit seiner Frau Heidi in Zernez. In Verbindung mit seiner Passion für die Natur ist er so lange wie möglich als Läufer aktiv.
Serge Denis, geboren 1974, hat nach der obligatorischen Schulzeit von 1980–89 eine Monopollehre als Gleismonteur bei der SBB abgeschlossen. Seither und bis zum Abschluss der vorliegenden Publikation ist er seiner Branche treu geblieben und in verschiedenen Führungsfunktionen tätig. Seit 1995 widmet er sich in seiner Freizeit der Überwachung und Erforschung des Steinadlers und Bartgeiers im Wallis und in Teilen des Waadtlands. Er arbeitet mit der Schweizerischen Vogelwarte und der Stiftung Pro Bartgeier zusammen und ist Mitverfasser diverser Publikationen. Ein Großteil seiner Freizeit verbringt er im Hochgebirge und widmet sich nebenbei auch der Tier- und Landschaftsfotografie. Auch das Motorradfahren bereitet ihm immer wieder Vergnügen. Er ist Vater einer Tochter und eines Sohnes und lebt mit seiner Familie in Lyss.

Lea Gredig, geboren 1989, wohnt in Samedan und hat an der Universität Basel Biologie studiert sowie an der Zürcher Hochschule der Künste Wissenschaftliche Illustration. Von 2017 bis 2024 war sie als Wissenschaftliche Illustratorin beim Archäologischen Dienst Graubünden tätig und seit ihrer Studienzeit arbeitet sie als freischaffende Illustratorin für botanische, paläontologische und zoologische Projekte, u. a. für den Botanischen Garten der Universität Basel, für das Paläontologische Institut der Universität Zürich, für das Bündner Naturmuseum oder das Naturmuseum Südtirol in Bozen. Ihre Illustrationen erschienen unter anderem 2021 in Die Mäuse und ihre Verwandten beim Haupt Verlag Bern sowie im selben Jahr in Mäusephilosophie bei Gammeter Media St. Moritz. Die Bleistiftzeichnungen im vorliegenden Buch sind Annamaria Gredig gewidmet.

Kapitel 5
Tab. 12 Entwicklung der Reviergrößen und Abstände zu nächsten Nachbarn (Distanz zwischen besetzten Horsten) seit ca. der Mitte des 20. Jahrhunderts in Graubünden. Haller (1996) und Ergänzungen von D. Jenny (Engadin unpubl. Daten).
Reviergrösse
Alte Reviere vor 1970
Neuere Reviere 1970 bis 1994
Mittlere Reviergrösse (km2) 59.2 ± 16.3 n = 17 46.8 ± 13.3 n = 12
Mittlerer Abstand zum nächsten Nachbarn (m) 5813 ± 2042 n = 64 4981 ± 1944 n = 29
Tab. 13 Beteiligung der Paarpartner bei territorialen Aktionen gegen Eindringlinge ins Territorium (D. Jenny 1992; Berner Oberland 1987–1991).
n = Stichprobengrösse. Männchen % Weibchen %
Territoriale Aktion gegen Fremdadler n = 55
Körperkontakt mit Fremdadler n = 148
Verfolgung eines Fremdadlers n = 48
Gegen Fremdadler gerichteter Girlandenflug n = 50
Girlandenbögen n = 594
Neue Reviere 1995 bis 2024 (nur Engadin)
33.9 ± 11.9 n = 7
3294 ± 608 n = 26
Abb. 3 Alter und Geschlecht der Kampfopfer in Graubünden 1870 bis 1994 (Haller 1996; n = 46;) und von 2004 bis 2024 (AJF und D. Jenny unpubl. Daten; n = 47).
Überlebensrate
Einzeladler pro Stunde
Anteil Girlandenflug
Abb. 4 Oben links: Jährliche Überlebensraten von insgesamt 31 zwischen 2017 und 2023 nestjung besenderten Steinadlern aus Graubünden in Prozent. Die zugeordneten Ziffern geben die Zahl der berücksichtigten Lebensjahre an, welche die Jungadler bis 2024 überlebten.
Abb. 5 Oben rechts: Verteilung der innerartlichen Beschädigungskämpfe mit Todesfolge im Jahresverlauf. Datengrundlage: von 1870 bis 1994 (Haller 1996; n = 43) und von 2004 bis 2024 (AJF und D. Jenny, unpubl. Daten; n = 48).
Abb. 6 Unten links: Anzahl ins Territorium «Giessbach BE» eingedrungene Fremdadler (Einzeladler) pro Beobachtungsstunde und Anteil Girlandenflug der Reviervögel an der gesamten Flugaktivität während der Wintermonate Dezember bis März 1986 bis 1990 (n = 321 Stunden; aus: Jenny 1992).
Abb. 7 Unten rechts: Nachwuchsrate (Anzahl flügge Jungvögel pro Paar und Jahr) bei 12 überwachten Bruten im Kanton Bern 1987–1991 und Horstpräsenz der Brutvögel auf dem Gelege (aus Jenny 1992).
Abb. 8 Rechts: Luftattacken von Steinadlern gegen Bartgeier und umgekehrt, aufgeteilt nach Aggressoren (n = 256). Datenerhebung erfolgte im Engadin und angrenzenden Gebieten 1997 bis 2024 (Lombardei, Mittelbünden, Bergell, Puschlav, Val Müstair; D. Jenny unpubl. 2024). Subadulte und immature Steinadler wurden nicht unterschieden.
Anzahl Kampfopfer
Attacken zwischen Steinadler und Bartgeier
Aggressor Steinadler gegen Bartgeier
Aggressor Bartgeier gegen Adler
1.Auflage: 2025
ISBN 978-3-258-08361-2
Umschlaggestaltung, Gestaltung und Satz: pool design, Zürich
Cover Vorderseite: Subadultes Steinadlermännchen des Adlerpaars Flüela (M. Meier, 31.01.2023, Davos GR). Rückseite: Zweijähriger Steinadler, der einen in einer Lawine umgekommenen Steinbock als winterliche Nahrungsquelle nutzt (H. Haller, 19.03.2021, Maloja GR).
Panoramen im Vor- und Nachsatz: Sommerbild (am Anfang) und Winterbild (am Schluss) der Val Roseg mit Steinadlerhorst im Vordergrund. Im Hintergrund das Berninamassiv mit dem Piz Glüschaint (3594 m).
Zitiervorschlag: Jenny, D., S. Denis & H. Haller (2025): Der Steinadler: eine Rückeroberung im Alpenraum. Haupt Verlag, Bern.
Alle Rechte vorbehalten.
Copyright © 2025 Haupt Verlag, Bern
Jede Art der Vervielfältigung ohne Genehmigung des Verlags ist unzulässig.
Kein Teil dieses Werkes darf in irgendeiner Weise für das Training von Technologien oder Systemen der künstlichen Intelligenz verwendet oder vervielfältigt werden. Die Verwendung der Inhalte für das Text- und Data-Mining ist untersagt.
Wir drucken mit mineralölfreien Farben und verwenden FSC®-zertifiziertes Papier. FSC® sichert die Nutzung der Wälder gemäß sozialen, ökonomischen und ökologischen Kriterien. Gedruckt in der Tschechischen Republik
Diese Publikation ist in der Deutschen Nationalbibliografie verzeichnet. Mehr Informationen dazu finden Sie unter http://dnb.dnb.de.
Der Haupt Verlag wird vom Bundesamt für Kultur für die Jahre 2021–2025 unterstützt.
Sie möchten nichts mehr verpassen?
Folgen Sie uns auf unseren Social-Media-Kanälen und bleiben Sie via Newsletter auf dem neuesten Stand. www.haupt.ch/informiert
Wir verlegen mit Freude und großem Engagement unsere Bücher. Daher freuen wir uns immer über Anregungen zum Programm und schätzen Hinweise auf Fehler im Buch, sollten uns welche unterlaufen sein.
Haupt Verlag AG Verantwortlich in der EU (GPSR): Falkenplatz 14 Brockhaus Kommissionsgeschäft GmbH CH-3012 Bern Kreidlerstr. 9
herstellung@haupt.ch DE-70806 Kornwestheim www.haupt.chhaupt@brocom.de

Kaum eine andere Vogelart fliegt majestätischer durch die Lüfte und wird mehr bewundert als der Steinadler. Seine Größe und sein «Charakterkopf» beeindrucken – nicht umsonst ziert er zahlreiche Wappen und wird mit Stärke sowie Freiheit assoziiert. Dieses Image ist ihm allerdings nicht immer gut bekommen: Noch bis weit ins 20. Jahrhundert wurde der Steinadler dämonisiert und rigoros bejagt – man unterstellte ihm gar Kinderraub. Kein Wunder, dass die Bestände vielerorts zusammenbrachen.
Dank seiner Unterschutzstellung und neuer wissenschaftlicher Erkenntnisse zu seinen Bedürfnissen haben sich die Populationen mittlerweile vollständig erholt, sodass er heute in allen alpinen Lebensräumen und auch in Teilen des Juras zu finden ist.
Dieses reich bebilderte Buch gewährt Einblick in das Leben und die Biologie des Steinadlers, sein Sozialverhalten und die Entwicklung der Jungvögel mit einem Fokus auf die Schweiz. Es fasst die neuesten Forschungsergebnisse zusammen und zeigt, wie ein Nebeneinander von Steinadler und Mensch im Alpenraum auch in Zukunft funktionieren kann.
ISBN 978-3-258-08361-2