Хімія

















На уроках хімії в 7 класі відбулося ваше знайомство із захопливою наукою про речовини та їх перетворення. Ви зрозуміли суть важливих хімічних термінів, з’ясували, що називають хімічними елементами, навчилися записувати хімічні формули речовин, здійснювати найпростіші хімічні розрахунки, виконувати досліди з речовинами
дження.
із найважливіших хімічних елементів, про властивості його простих речовин — кисню і озону. Довідаєтеся про процеси горіння й окиснення, реакції сполучення і розкладу. Речовин є безліч, а частинок, з яких вони складаються, — лише три типи. Що таке атом і молекула, вам уже відомо, а про йони ви незабаром дізнаєтеся. Розглядатимемо будову частинок кожного типу, з’ясуємо, чому і як вони сполучаються
На початку кожного параграфа є запитання, які анонсують і актуалізують розміщений у ньому матеріал. Основнi означення виокремлено в тексті кольором, а новi термiни, важливі твердження і слова з логічним наголосом — курсивним шрифтом. За QR-кодами ви можете переглянути хімічні досліди та ознайомитися з інформацією, яка доповнює викладене на сторінках підручника. У кожному параграфі та після нього наведено завдання, вправи й задачі. Умовні позначки (піктограми)
вам зорієнтуватися в типах завдань, спонукатимуть до певних дій:




Думаймо

Варто знати

Відшукаймо

Експериментуймо Виконаймо вправу Обговорюймо

Частина завдань призначена для виконання групою учнів/учениць (зазвичай у складі
знання з хімії.

Ви продовжуватимете досліджувати речовини, їхні властивості, набудете навичок з дослідження хімічних реакцій. До хімічних експериментів необхідно ретельно готуватися. Спосіб і послідовність їх виконання описано в підручнику. Рекомендації щодо правил роботи і безпеки в хімічному кабінеті / лабораторії, яких ви дотримувалися в 7 класі, виконуйте і в цьому навчальному році. Будьте обережними! Невміле поводження з речовинами на уроках і вдома, нехтування правилами безпеки можуть зашкодити вашому здоров’ю. Домашній експеримент виконуйте лише з дозволу батьків або ваших рідних. До підручника на платформі ВШО створено е-додаток (https://lms.e-school.net.ua/courses/course-v1:UIED+ 8thChem04+2024/course/ — з реєстрацією), на якому розміщено підручник в електронному вигляді, тестові завдання для самоперевірки, діагностувальні роботи до кожного півріччя, відеоматеріали, матеріали для вчителя. Деякі матеріали з е-додатка, використання яких не потребує реєстації, розміщені на https://h8.academiabook.club/ та https://learningapps.org/.
Кожен із вас уже переконався, що вивчати хімію необхідно для того, щоб розуміти, як побудований навколишній світ, за якими законами він розвивається, щоб уміти використовувати різні речовини безпечно, не руйнуючи природу, а оберігаючи й примножуючи її багатства. Багато з того, про що дізнаєтеся і що практично випробуєте, знадобиться вам у майбутньому.
Бажаємо вам успіхів у навчанні!
Що ви вже знаєте з хімії
Світ речовин дивує і зачаровує своїм багатством та різноманіттям. Речовини є всюди — у літосфері, гідросфері, повітрі, космосі, живих організмах. Одні речовини надають квітам чудових кольорів, інші зумовлюють їхні неповторні запахи. Кристали мінералів дивують своєю формою і забарвленням. Кожній речовині притаманні склад, будова і властивості.
У природі щомиті відбуваються перетворення речовин. Найважливішим для рослин є процес фотосинтезу. Кисень, який потрапляє в організми під час дихання, взаємодіє з багатьма речовинами. Хімічні реакції — це складова частина багатьох технологічних процесів. Наукою про речовини та їх перетворення є хімія. Ми допоможемо вам відновити в пам’яті важливий матеріал із цього навчального предмета

1. Опишіть модель найпростішого атома.
2. Про що свідчить таке твердження: якщо
становить +1, то в атомі міститься один електрон, а якщо +2 — два електрони?
В алмазі, залізі, міді та багатьох інших речовинах усі атоми сполучені між собою, а, наприклад, у
тинкою (мал. 1).



не абсолютні
Відносну атомну



няться зарядами ядер, складом, масою. Вид атомів
ядра називають хімічним елементом. Нині відомо 118 хімічних елементів. Їхні позначення (символи) і назви такі самі, як і відповідних атомів. Ви вже знаєте, що найважливіша інформація про хімічні елементи є
Не
2
4,0026


також
таблиці за збільшенням
атомів, а значення заряду ядра збігається з порядковим номером хімічного елемента.

Назвіть заряди ядер атомів






2.
3. Випишіть із періодичної таблиці символи
заряди ядер атомів яких становлять +3, +5 і +9.
Аналізуймо
4. Напишіть хімічні формули за їх вимовою: о-три, це-два-аш-п’ятьо-аш, хром-два-ес-о-чотири-тричі, ен-аш-чотири-двічі-це-о-три.
5. Що легше — 2 атоми Сульфуру чи 8 атомів Гелію? У скільки разів?
Завдання для групи
6.* Укажіть помилки/неточності у твердженні «Інертні гази — гелій, неон, аргон та ін. — перебувають
таблиці та складаються з одноатомних молекул». Запропонуйте коректний варіант твердження. Дізнаваймося
7.
Розв'язуймо задачу
10. Обчисліть відношення мас молекул: а) амоніаку NH3 і сірководню H2S; б) брому Br2 і сірчистого газу SO2.
Оцінюймо свої знання
11. Оцініть, як ви засвоїли матеріал параграфа. Створіть у зошиті таблицю оцінювання
Мені було легко зрозуміти ...
Мені було важко зрозуміти ...
Мені було цікаво
Пригадаєте, використаєте

1. Назвіть кілька простих речовин. Яким хімічним елементом утворена кожна з них?
2. Яка із трьох «сфер» нашої планети — атмосфера, гідросфера чи літосфера — майже цілком складається з простих речовин?
Назви більшості простих речовин такі самі, що й назви хімічних елементів, якими вони утворені. Якщо назва речовини інша, її подано в періодичній таблиці нижче від
хімічного елемента (мал. 4).
7
14,0067


Для скількох
простих речовин відрізняються від назв елементів? Назвіть ці речовини. Зробіть
Hydrogen is a component of water molecule. Hydrogen has no colour, taste, smell.
Поясніть різний переклад перших слів у реченнях.
Ви знаєте, що прості речовини поділяють на метали і неметали (мал. 5). Метали і неметали у твердому стані



Мал. 5. Прості речовини

З-поміж металів вольфрам
температури (3420 С), а ртуть — за найнижчої (–38,9 С) і за стандартних умов є рідиною.
Неметали можуть мати як атомну, так і молекулярну будову. В алмазі та графіті атоми з’єднані один з одним, а інертні гази — гелій, неон, аргон, криптон, ксенон, радон — складаються з окремих (ізольованих) атомів. Решта газуватих неметалів, бром (рідина), кілька твердих неметалів (серед них — сірка, йод) є молекулярними речовинами. Властивості неметалів, як і металів, також залежать від їхньої будови.
1. Узгодьте назву речовини та температуру її плавлення: Речовина Температура плавлення, °С

1. Гелій А. –7
2. Залізо Б. +100
3. Бром В. –272 Г. +1536 2.


Деякі хімічні елементи утворюють по кілька простих речовин, які різняться складом молекул або будовою
сполучення атомів, розміщенням атомів і молекул у кристалах. Оксиген утворює дві прості речовини — кисень О2 й озон О3, а Карбон і Фосфор — більше. Отже, загальна кількість простих речовин перевищує кількість хімічних елементів.

Назвіть хімічний елемент, з атомів якого складаються прості речовини алмаз і графіт. Яка загальна назва простих речовин цього елемента?
Хімічні елементи, які утворюють метали, називають металічними, а ті, що утворюють неметали, — неметалічними. У довгому варіанті періодичної таблиці (форзац 2) вони розмежовані діагональною ламаною лінією; ліворуч від неї перебувають металічні елементи, а праворуч — неметалічні. Складні речовини. Речовину, утворену двома або більшою кількістю хімічних елементів, називають складною. Інша загальна назва складних речовин — сполуки. Цих речовин відомо понад 150 млн. Вони різняться складом і будовою.
Складні речовини є компонентами природного газу, нафти, бетону, кераміки, фарб, мінеральних добрив. Вони містяться в харчових продуктах, медичних засобах, а також у живих організмах. Приклади складних речовин: гідроген пероксид H2O2, етиловий спирт C2H5OH, оцтова кислота СН3СООН, глюкоза С6Н12О6. У якій із цих речовин масова частка Оксигену найбільша, а в яких речовинах — однакова? Відповіді підготуйте, порівнявши хімічні формули речовин. Переважна більшість складних речовин має молекулярну




Мал. 6. Складні речовини
Перевірмо себе
1. Назвіть речовини серед тих, формули яких наведено, що проводять електричний струм: He, H2, Cu, C, Al, Ar, Со. Яке уточнення щодо однієї простої речовини необхідно вказати?
2. Вставте назви хімічного елемента № 9 і його простої речовини у відповідних відмінках у речення «Проста речовина … складається з молекул, кожна з яких містить два атоми …».
3. Чим можуть відрізнятися одна від одної складні речовини?
Поміркуймо
4. Назвіть складні речовини, дуже поширені в природі.
5. Доведіть помилковість твердження «Найменшою частинкою простої речовини є хімічний елемент».
6. Укажіть некоректність в описі складу медичного препарату (мал. 7).

Мал. 7. Фрагмент упаковки медичного препарату
Аналізуймо
7. Установіть відповідність і поясніть свій вибір. Речення Значення першого слова
1. Алюміній посідає третє місце А. Хімічний елемент. за поширеністю в земній корі. Б. Проста речовина.
2. Алюміній використовують в електротехніці.
3. Алюміній перебуває в 3-му періоді періодичної таблиці.
4. Алюміній є компонентом легких сплавів.
Розв'язуймо задачу
8. За формулою оцтової кислоти СН3СООН обчисліть: а) відносну молекулярну масу речовини; б) відношення кількості атомів хімічних елементів; в) масову частку Карбону
9. Обчисліть
Пригадаєте, використаєте Чим різняться фізичні


1. Назвіть кілька фізичних властивостей речовин. Які фізичні властивості є специфічними для твердих речовин; рідких речовин?
2. Опишіть фізичні властивості однієї з відомих вам речовин.
Які властивості кисню є фізичними, а які — хімічними: а) погано розчиняється у воді; б) не горить; в) трохи важчий за повітря; г) підтримує горіння речовин; д) зріджується за дуже низької температури?
Перетворення речовин. До фізичних перетворень речовин, або фізичних явищ, належать, наприклад, зміна агрегатного стану речовини, процес її розчинення у воді. Хімічні явища — це перетворення речовин на інші речовини. Їх називають хімічними реакціями. Хімічні реакції. Хімічні перетворення речовин
ням забарвлення чи запаху, утворенням




1.




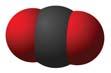

2.
I. AB + CD AC + BD; IV. ABC A + BC;
II. AB + C AC + B; V. A + BC ABC.
III. A + B AB;
Безліч хімічних реакцій відбувається
стеблах рослин проходить фотосинтез,
живих організмах утворюються білки, жири, вуглеводи, ферменти, гормони, інші речовини.

Назвіть реагенти у фотосинтезі.
Лісові пожежі, жевріння торфу, гниття рослинних залишків — це теж хімічні реакції. У печерах деякі речовини, розчинені у воді, перетворюються на нерозчинні, з яких формуються «бурульки» (сталактити) і нарости різної




(мал. 10), виготовлення
під час виробництва

Мал. 9. Горіння

Мал. 10.

Мал. 11.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про фізичні та хімічні властивості речовин, фізичні та хімічні явища (хімічні реакції).

Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям. Зіставте свою і їхні відповіді
4. Які речовини є продуктами реакції горіння природного газу (метану)? Запишіть їхні хімічні формули.
Виконаймо вправу
5.* Водний розчин перекису водню Н2О2 є медичним засобом (мал. 12). Він має обмежений термін придатності, оскільки розчинена речовина повільно розкладається на газ, який міститься в атмосфері, і дуже поширену складну речовину. Запишіть схему цієї хімічної реакції за допомогою формул реагента і продуктів.
Аналізуймо

Мал. 12.
6. Кристалічна речовина за високої температури перетворюється на порошок речовини Cr2O3, газ азот і пару. Назвіть хімічні елементи, якими утворена кристалічна речовина. Переглянувши дослід (див. QR-код або https://h8.academiabook.club/vstup-p-3. html), укажіть зовнішні ефекти, якими супроводжується це хімічне явище. Експериментуймо

7. Налийте у склянку свіжого непастеризованого молока, прикрийте серветкою і залиште для скисання. Через один-два дні розгляньте вміст склянки. Які сталися зміни? Чи з’явився характерний запах? Спробуйте вміст склянки на смак, порівняйте зі смаком свіжого молока. Доведіть, що під час скисання молока відбуваються хімічні перетворення речовин.
У команді
8. Складіть перелік кількох харчових продуктів, які внаслідок хімічних реакцій швидко псуються під час зберігання, і продуктів, що протягом тривалого часу

Основними завданнями науковців/науковиць є одержання та дослідження речовин, а також їх перетворень. Хімічні перетворення речовин (хімічні реакції) відбуваються
воджуватися утворенням газу
виділенням або поглинанням теплоти, появою полум’я та іншими зовнішніми ефектами. Дослідження хімічних реакцій
складний процес, який потребує ретельної підготовки експерименту, вибору необхідних реактивів та обладнання, дотримання правил безпеки. Результатом кожного дослідження є запис хімічної реакції, зазначення умов її перебігу, формулювання висновків.
Ви здійснюватимете хімічні реакції, спостерігатимете за ними, навчитеся їх досліджувати. Бажаємо вам позитивних вражень від хімічних експериментів.
(мал. 13, а). Якщо ж нагрівати блискучий
(мал. 13, б), виявимо протилежне — його
і на металі з’являється чорний наліт. Алхіміки пояснювали зміну маси речовин тим, що речовини під час перетворень виділяють
невидиму субстанцію — флогістон.
Пояснимо, чому маса попелу
(мал. 13, а).


Мал.

повітря1 (тепер ми знаємо, що це — кисень), і тому в посудинах
зменшитися тиск. Відкривши посудини, Лавуазьє зафіксував швидке входження повітря в кожну з них.
Отже, перетворення металу на іншу речовину внаслідок
взаємодії з киснем не спричиняє зміну загальної
продукту реакції така сама, що й сума мас

реакції. Закон збереження маси речовин під час хімічної реакції формулюють так: маса речовин, що взяли участь
масі речовин, які


Мал.




2. Унаслідок нагрівання
було одержано кальциновану соду масою 53 г. Обидві соди є твердими речовинами. Про що свідчить результат експерименту?
Розв'язуймо задачу
3. Обчисліть масу сірки, яка прореагувала
маса єдиного продукту реакції — 29,5 г.
Завдання для групи
4. Як науковець/науковиця може застосовувати у
збереження маси речовин під час хімічної реакції?
Поміркуймо
5. Поясніть, чому маса іржавого цвяха більша, ніж нового й непошкодженого.
Аналізуймо
6. Спирт або бензин (суміш речовин), згоряючи, «зникають». Чи не суперечить це закону збереження маси речовин під час хімічної реакції? Відповідь аргументуйте.
7.* Дослідник після повної взаємодії
жав єдиний
Обов’язковий атрибут науковця і науковиці
лабораторний журнал. У ньому записують план дослідження, відомості про речовини, спостереження, результати вимірювань, обчислення, висновки, завдання на перспективу. Нотатки про свої експерименти робили ще алхіміки. Приклад запису хімічної реакції в ті часи1:

Дізнаєтеся, зрозумієте, використаєте Що називають схемою хімічної реакції? Як перетворити схему реакції на хімічне рівняння?

Чому в період становлення хімічної науки дослідники відмовилися від алхімічних символів?
Схема хімічної реакції. Описувати хімічні реакції можна по-різному. Один зі способів передбачає використання моделей молекул, інший
сірка + кисень сірчистий газ.
У словесній схемі


хімічної
амоніак
акція
ронньої» речовини — платини.
Хімічне рівняння. Оскільки
кількості його атомів після реакції. На це вказують
Працюємо разом
Перетворимо останню
два атоми Оксигену, поставимо перед формулою води коефіцієнт 2: t H2 + O2 2H2O.
Тепер атомів Гідрогену в правій частині схеми — чотири. Щоб така сама кількість атомів Гідрогену була і в лівій частині, запишемо перед формулою водню коефіцієнт 2. Отримуємо хімічне рівняння:
Отже, щоб перетворити схему реакції на хімічне рівняння, потрібно порівняти кількості атомів
схеми, дібрати (за потреби) коефіцієнти для кожної речовини,
потрібно зробити.
Працюємо разом
Перетворимо на хімічне рівняння схему реакції Al + H2SO4 Al2(SO4)3 + H2.
У лівій частині цієї схеми міститься один атом Алюмінію, а в правій — два. Запишемо перед формулою металу коефіцієнт 2:
2Al + H2SO4 Al2(SO4)3 + H2.
Атомів Сульфуру праворуч утричі більше, ніж ліворуч. Додамо в ліву частину схеми перед формулою сполуки Сульфуру коефіцієнт 3:
2Al + 3H2SO4 Al2(SO4)3 + H2.
Тепер у лівій частині кількість атомів

3.
Прокоментуйте додаткові позначки в схемах реакцій і складіть відповідні хімічні рівняння: hv а) AgCl Ag + Cl2; t Fe2O3 + C Fe + CO; t, p, Pt б) N2 + H2 NH3; Na2CO3 + Ca(OH)2 CaCO3 + NaOH.
Прочитайте хімічне рівняння: 2FeCl3 + 3Ba(OH)2 = 2Fe(OH)3 + 3BaCl2.
Виконаймо вправу
4.
Допишіть пропущені коефіцієнти
хімічних рівняннях: t а) 2B + S = B2S3; Li2O + 2HBr = LiBr + H2O; б) Al + HCl = 2AlCl3 + H2; t 4HNO3 = NO2 + O2 + H2O.
5. Перетворіть схеми реакцій на хімічні рівняння: t а) Cr(OH)3 Cr2O3 + H2O; Na + H2O NaOH + H2; б) CaH2 + H2O Ca(OH)2 + H2; Ba(OH)2 + P2O5 Ba3(PO4)2 + H2O.
6. Запишіть замість крапок формули простих речовин і складіть хімічні рівняння: t t а) … + … PCl5; б) … + … HCl; t t … + … B2O3; … + … CF4.
найшла синтезатор молекул — пристрій, що синтезує молекули з інших молекул. Формули всіх частинок закладають у програму пристрою. Визначте, скільки молекул вуглекислого газу і води знадобиться для синтезу кожної молекули лимонної кислоти С3Н4(ОН)(СООН)3. Атоми якого хімічного елемента
команді
8.* Поясніть, чим хімічне рівняння подібне до математичного
Розв'язуймо задачу
9. Обчисліть масу негашеного вапна, яку було одержано після тривалого прожарювання крейди масою 50
Дізнаєтеся, зрозумієте, використаєте
Як одержують кисень?
Яку речовину називають каталізатором?
Як зібрати одержаний кисень?
Одержання кисню в промисловості. Невичерпним джерелом кисню є повітря. Щоб одержати з нього кисень, потрібно відокремити цей
від азоту та інших газів. На цьому ґрунтується промисловий метод. Його реалізують, використовуючи спеціальну, досить громіздку апаратуру. Повітря сильно охолоджують до перетворення його на рідину, а потім температуру зрідженого повітря поступово підвищують. Спочатку з нього виділяється переважно газ азот (температура кипіння рідкого азоту –196 С). Рідина, що залишається, поступово збагачується киснем (температура кипіння рідкого кисню –183 С). Унаслідок зрідження і випаровування суміші речовин одержують
окремо азот і кисень.
Рідкий кисень транспортують у спеціальних сталевих резервуарах, що мають подвійні стінки, між якими створено вакуум (для ефективної теплоізоляції). Газуватим киснем наповнюють під високим тиском балони; їх фарбують у блакитний колір (мал. 15).



Мал. 15.
За матеріалами з інтернету довідайтеся, якими ще газами наповнюють металеві балони і в який колір пофарбований балон з кожним газом.
Чому в лікарнях використовують балони з киснем, а
дайвінгу — балони

(https://h8.academiabook.club/p-7-kusen.
text
у вигляді сріблястих крапель. Кисень накопичується
водою).



Мал. 16. Одержання кисню нагріванням речовини
кисню. Рівняння цієї реакції: MnO2 2Н2O2 = 2Н2О
(https://h8.academiabook.club/p-7katalizator.html).


Слово «каталізатор» використовують не лише в хімії. Наведіть приклади речень із цим словом, які стосуються діяльності людей.
Кисень утворюється під час розкладу
ного струму: ел. струм 2Н2О = 2Н2
Цей спосіб одержання кисню використовують у демонстраційному експерименті (мал. 17). Побачити його ви зможете за покликанням у QR-коді (https://h8.academiabook. club/p-7-video.html).




video
Мал. 17. Розклад води постійним електричним струмом
Висловте гіпотезу стосовно того, про що може свідчити вдвічі більший об’єм водню, ніж кисню (мал. 17).
Першим виявив, що вода розкладається електричним струмом, англійський фізик і хімік Вільям Ніколсон у 1800 р. Він застосував в експерименті сконструйовану разом з колегою електричну батарею.
Збирання кисню. Оскільки кисень розчиняється у
збирають,





Мал. 18.
Збирання кисню:
а — витисненням води;
б — витисненням повітря
Мал. 19.
Виявлення кисню:
а — скіпка, що тліє
в повітрі;
б — спалахування скіпки в кисні

кожний спосіб? У якому разі не можна
мент, коли посудина цілком заповнена киснем?
2. Яку речовину називають каталізатором?
Аналізуймо
3. Чому, на вашу думку, для одержання кисню в промисловості не використовують гідроген пероксид?
4. На малюнку 20 зафіксовано момент розкладу білої твердої речовини, формула якої — Cd(NO3)2.
Уважно розгляньте малюнок та опишіть, що відбувається під час реакції. Чому спалахує скіпка, що тліє? Складіть відповідне хімічне рівняння.
5. Чи можна, з огляду на викладене в параграфі, класифікувати хімічні реакції на два типи — каталітичні та некаталітичні? Відповідь аргументуйте.
Виконаймо вправу

6. Перетворіть на хімічні рівняння схеми реакцій,
час яких утворюється кисень: t t а) Ag2O Ag + O2; б) Al(NO3)3 Al2O3 + NO2 + O2; t t Mn2O7 MnO2 + O2; Ag2CO3 Ag + CO2 + O2.
Розв'язуймо задачу
7.* Студентка одержала кисень, нагріваючи речовину NaNO3. Схема цієї реакції:
Формуймо словничок
свої

Експериментуємо в хімічному кабінеті/лабораторії
ОДЕРЖУЄМО КИСЕНЬ
Дотримуйтеся правил безпеки!
Для виконання експерименту вам потрібні водний розчин гідроген пероксиду, каталізатор — речовина MnO2, а також прилад для одержання газу, склянка, промивалка з водою, шпатель, штатив для пробірок, пробірка для збирання газу, дерев’яна скіпка, спиртівка/сухе пальне, сірники. Працюючи з вогнем, будьте обережними.
Передусім підготуйте в зошиті таблицю, у яку під час експерименту записуйте свої
та спостереження, а після його завершення — висновки і рівняння реакції:
ДіїСпостереженняВисновки
Рівняння реакції:
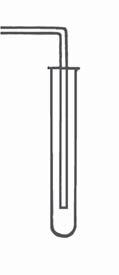
Складаємо прилад. Щоб зробити прилад для одержання газу (мал. 21), потрібні пробірка та гумовий корок з отвором, у який уставлена трубка (її називають газовідвідною). Щільно закрийте пробірку корком із
трубкою, ніби вкручуючи корок.

Мал. 21.

Мал. 22.

Мал. 23.
речовини MnO2. Що спостерігаєте?
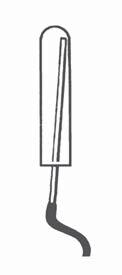
Одразу закрийте пробірку
кою, поставте у штатив для пробірок1, а кінець трубки опустіть до дна іншої пробірки (мал. 23).
Виявляємо кисень. Через кілька хвилин запаліть спиртівку чи сухе пальне, підпаліть від полум’я довгу дерев’яну скіпку і пригасіть її (як це ви робите із сірником), щоб вона ледве тліла. За допомогою скіпки доведіть, що зібраний газ — кисень.
Після

рігаєте?
Доведіть, що газ, який утворюється, — кисень. У якій пробірці гідроген пероксид розкладається інтенсивніше?
Зробіть висновок про те, як залежить швидкість розкладу гідроген пероксиду від температури.
МІРКУЄМО,
цієї палички зумовлена тим, що її голівка містить сірку.
Кисень реагує з азотом за особливих умов. Взаємодія між невеликими кількостями цих газів відбувається лише тоді, коли в повітрі виникають блискавки.
Дізнаєтеся, зрозумієте, використаєте
Як кисень взаємодіє з металами і неметалами?
Які зовнішні ефекти реакцій кисню з простими речовинами?
Хімічні властивості кожної речовини виявляються в реакціях
її участю.
Кисень — один із найактивніших неметалів. Однак за стандартних умов
здатність інших речовин до хімічних перетворень, істотно зростає з підвищенням температури.
Реакції кисню з простими речовинами. Кисень взаємодіє (зазвичай у разі нагрівання) з більшістю неметалів і майже з усіма металами.
Реакція з вуглецем (вугіллям). Відомо, що вугілля, нагріте в повітрі до високої температури, загоряється. Це свідчить про перебіг хімічної реакції.
Основним продуктом згоряння вугілля є вуглекислий газ CO2. Вугілля — суміш багатьох речовин. Масова частка Карбону в ньому перевищує 80 %. Припустивши, що вугілля складається лише з атомів Карбону, напишемо відповідне хімічне рівняння: t C + O2 = CO2.
полум’ям.
помістити над полум’ям скляну пластинку. На ній

Складіть рівняння реакції горіння водню.
Суміш водню з повітрям або киснем у разі підпалювання вибухає.
Реакція із сіркою. У лабораторії перебіг реакції кисню із сіркою демонструють, здійснюючи дослід у витяжній шафі. Невелику кількість сірки (мал. 24, а) нагрівають у залізній ложці. Речовина спочатку плавиться, а потім загоряється внаслідок взаємодії з киснем повітря і горить ледь помітним блакитним полум’ям (мал. 24, б). З’являється різкий запах продукту реакції — сірчистого газу (цей запах ми відчуваємо в момент загоряння сірника). Хімічна формула сірчистого газу — SO2, а рівняння реакції — t S + O2 = SO2.
Якщо ложку із сіркою, що горить, помістити




(мал. 25). Унаслідок реакції утворюється біла тверда речовина — сполука Магнію
(https://h8.academiabook.club/p-8.html).



Мал. 25.

Дослід зі спалювання сталевої пружинки (або леза) є яскравим (мал. 26). На пружинці закріплюють сірник. Потім пружинку затискують у лабораторних щипцях, а сірник


темно-червоного («мідного») кольору на темно-сірий. Такий колір має плівка речовини, утвореної Купрумом і Оксигеном, що вкрила мідь. Формула цієї речовини — CuO.


Складіть рівняння реакції міді з киснем.
За матеріалами з інтернету з’ясуйте, з якими металами і
Проаналізувавши матеріал, викладений у параграфі, запишіть

дження обох колб до однакової температури виявили, що в одній із них тиск зменшився. У якій саме? Відповідь аргументуйте.
Формуймо словничок
6. Випишіть ключові слова і словосполучення
укладання двомовного словничка.
Оцінюймо свої знання 7. Створіть
же цілком складається природний газ). У разі використання балонів зі скрапленим газом полум’я виникає внаслідок взаємодії
інших складних речовин — пропану й бутану.
Дізнаєтеся, зрозумієте, використаєте
Як кисень взаємодіє зі складними речовинами? Які сполуки називають оксидами?
Реакції кисню зі складними речовинами. У повітрі в разі підпалювання загоряються не лише метан, пропан, бутан, а й рідкі (мал. 27) та тверді

t CH4 + 2O2 = CO2 + 2H2O; t С2Н5ОН + 3О2 = 2СО2 + 3Н2О.
Такі самі продукти реакцій горіння деревини, нафтопродуктів, багатьох органічних речовин.
Гідроген сульфід, або сірководень, — газ, що має формулу H2S. У кисні чи надлишку повітря він горить з утворенням сірчистого газу і водяної пари: t H2S + O2 SO2 + H2O.

Перетворіть схему реакції
рівняння.
Кисень взаємодіє з деякими сполуками елементів з Оксигеном. На-
лий газ: t 2CО + O2 = 2CO2. Продукти таких реакцій

крім пари, вуглекислий, чадний і сірчистий
гази. Вуглекислий газ посилює парниковий
ефект на планеті (зумовлює загальне підвищення температури), а чадний і сірчистий
гази є шкідливими для живих організмів.
Тому нині відбувається поступовий перехід від традиційних


в атмосферу.
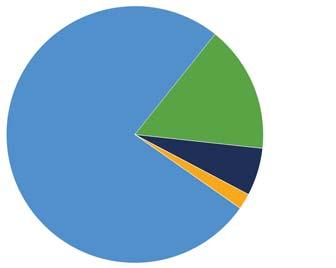
За діаграмою (мал. 28) визначте, у скільки разів внесок вуглекислого газу в парниковий ефект більший, ніж метану.
Україна ратифікувала Кіотський протокол у 2004 р. і приєдналася до Паризької кліматичної угоди в 2015 р. Як держава, що скоротила викиди парникових газів через низьке завантаження промисловості, Україна отримала можливість реалізовувати невикористані нею квоти. Від продажу надлишків квот до державного бюджету надходять значні кошти. Україна спрямовує їх на заходи зі скорочення газових викидів.

Складіть схему «Основні джерела
Оксиди. Продукти реакцій, розглянутих у цьому та попередньому параграфах, мають подібний якісний склад.
Сполуку, утворену двома хімічними елементами, одним з яких є Оксиген, називають оксидом.
Склад майже всіх оксидів відповідає загальній формулі ЕmОn, у якій індекс m може набувати значення 1 або 2. Кожний оксид, крім хімічної формули, має назву. У таблиці 1 наведено формули і традиційні, або тривіальні1,
хімічними назвами цих речовин ви ознайомитеся згодом. Таблиця 1 Формули і назви оксидів ФормулаТрадиційна (тривіальна) назва CO2 Вуглекислий газ
COЧадний газ
вапно
Сірчистий газ
Залізна окалина

У якому оксиді (таблиця 1) відношення мас хімічних елементів становить: а) 1 : 1; б) 3 : 4; в) 5 : 4?
Поширеність оксидів у природі. Оксиди містяться в атмосфері, гідросфері, літосфері. У повітрі є невелика кількість водяної пари та вуглекислого газу. Гідросфера складається
речовин (їхня сумарна масова частка
відсотків).





1.
наведених формул ті, що відповідають оксидам: O2, NaOH, H2O, HCl, I2O5, BaO.
2. Один зі способів зварювання
ґрунтується на використанні ацетиленового пальника. Складіть рівняння реакції горіння ацетилену С2Н2 в повітрі.
Поміркуймо
3. Які умови потрібно створити, щоб, спалюючи паливо,
утворенню чадного газу?
Виконаймо вправу
4. Допишіть формулу простої речовини в кожній схемі реакції і складіть хімічні рівняння: а) NO + … NO2; t б) CS2 + … CO2 + SO2.
5.
Порівняйте умови перебігу обох реакцій.
Перетворіть схеми реакцій на хімічні рівняння: t t а) FeO + O2 Fe2O3; б) Mn2O3 + O2 MnO2; t t SiH4 + O2 SiO2 + H2O; NH3 + O2 N2 + H2O. 6. Складіть рівняння реакцій горіння в повітрі ацетону (СН3)2СО й етеру (С2Н5)2О. Візьміть
зберігала
З часом
сама «виробляти» вогонь — тертям дерев’яних паличок, викрешуванням твердими камінцями. У наш час без використання процесів, що супроводжуються горінням, не можуть функціонувати енергетика, промисловість, транспорт, інші сфери. На жаль, вогонь завдає також і нещастя. Пожежі, збройні конфлікти призводять до великих втрат природних багатств, створених людиною цінностей, забирають життя.
Дізнаєтеся, зрозумієте, використаєте Які хімічні перетворення називають горінням; окисненням?
За яких умов загоряється паливна речовина?
Як гасять пожежі?
Горіння. Більшість реакцій, розглянутих у двох попередніх параграфах,

Кисень підтримує горіння речовин, але сам не горить.
Для того щоб паливна речовина загорілася, необхідні такі умови:
наявність кисню (повітря) і його контакт з речовиною;
нагрівання речовини до температури займання (для бензину вона становить приблизно 220 С, сухої деревини 250—300 С, вугілля — понад 600 С).
Якщо відсутня хоча б одна з умов, то горіння не відбувається. Це
беруть до уваги, працюючи з вогненебезпечними речовинами, а також коли гасять пожежі.

Якщо бензин підпалити, то він горітиме, поки весь не згорить. Поясніть, чому речовину не треба постійно підпалювати.
Речовини або предмети, що горять, можна загасити водою, піском, ґрунтом, накрити ковдрою чи спрямувати на них струмінь вуглекислого газу (він важчий
(мал. 30).



Мал. 30.



Чому для гасіння пожеж найчастіше використовують воду?
Зауважимо, що водою не можна
бензин, гас, нафту. Ці рідини не розчиняються у воді й, оскільки мають меншу густину, ніж вода, спливають, залишаючись у контакті з повітрям.


За матеріалами з інтернету з'ясуйте, які інші речовини не гасять водою і чому.
Горінням можуть супроводжуватися не лише
тю кисню. Деякі речовини горять у
Окиснення. Речовина, взаємодіючи
то змінюється
участю кисню. Процеси
можуть відбуватися швидко, але без появи полум’я. Серед них — взаємодія кисню з
нієм за стандартних умов. Її наслідком є утворення


Як можна запобігти псуванню харчових продуктів, спричиненому дією кисню?
Чимало паливних речовин не здатні до повільного окиснення. Наприклад, спирт, ацетон, бензин, контактуючи з повітрям, не зазнають жодних змін.

Чи є будь-яке горіння окисненням і навпаки?
Пожежна безпека. Людина має постійно дбати про власну безпеку і безпеку близьких, а також робити все можливе для збереження довкілля. Завершуючи свій відпочинок у лісі або біля річки, потрібно загасити тліюче вогнище, щоб запобігти пожежі. У шкільному хімічному кабінеті/лабораторії ви маєте дотримуватися правил безпечного поводження з вогнем. Використовуючи спиртівку або сухе пальне, будьте уважними та обережними. Займисті речі розміщуйте подалі від вогню, а якщо у вас
Ви вже знаєте, де в хімічному кабінеті/лабораторії є протипожежні засоби — вогнегасник, ковдра і


необхідні для перебігу цього процесу.
2. Як можна загасити полум’я? 3. Який із термінів — «горіння» чи «окиснення» — є більш загальним? Відповідь обґрунтуйте. Виконаймо вправу
4. Основу сухого пального становить речовина, формула якої — (СH2)6N4, а назва — уротропін. Складіть рівняння реакції горіння цієї речовини, якщо утворюються
які є в повітрі.
розжарювання відбувається горіння металевої (вольфрамової)
Формуймо словничок
10. Випишіть ключові слова і словосполучення
укладання двомовного словничка.
Оцінюймо свої знання
11. Створіть у зошиті таблицю оцінювання
ніть

вин із
виготовляють
з утворенням вуглекислого газу і води. Переконайтеся
цьому, виконавши дослід.
Вам знадобляться, крім свічки, дві склянки ємністю 200— 250 мл і прозорий розчин гашеного вапна (назва цього розчину — вапняна вода).
Запаліть свічку. Візьміть одну склянку, переверніть догори дном і тримайте її на відстані 1—2 см від кінця полум’я1. За кілька хвилин на внутрішніх стінках склянки почнуть з’являтися краплинки води.
Унаслідок яких хімічного і фізичного явищ утворюється вода? Другу склянку змочіть
Краплі рідини на стінках склянки поступово стають каламутними


10. Озон
кисню і атом Оксигену. Цей атом взаємодіє з іншою молекулою озону з утворенням двох молекул кисню.

Змоделюйте в зошиті або на власній електронній сторінці ці перетворення за
допомогою моделей частинок і складіть відповідні хімічні рівняння.

Озон за хімічними властивостями подібний до кисню, але значно активніший від нього. Серед продуктів більшості реакцій озону з простими і складними речовинами є кисень: NO + О3 = NО2 + О2.

Висловте гіпотезу стосовно того, що
лами озону в цих реакціях.
можна виявити за допомогою
водного розчину речовини, формула якої — KI. Одним із продуктів реакції між цими речовинами є йод, який, розчиняючись, надає рідині бурого забарвлення. Якщо використати розчин суміші KI і крохмалю, то йод взаємодіятиме з крохмалем з утворенням речовини темно-синього кольору. Для виявлення озону користуються фільтрувальним папером, просоченим розчином цієї суміші. Одержання озону. Озон одержують, пропускаючи кисень через трубку з металевими електродами. За допомогою змінного електричного струму в трубці створюють тихий електричний розряд.
відного приладу
озонатор.
суміш кисню та озону, об’ємна частка якого в суміші газів може становити до 10 %1. Перетворення кисню на

або електричних розрядів (коли виникають блискавки).
Значення озону для живих організмів. Озон досить швидко перетворюється на кисень, поглинаючи при цьому частину ультрафіолетових променів сонячного світла (мал. 33), які є шкідливими для живих організмів. Отже, розкладаючись, озон захищає людей, тварин, рослини.

У природі процеси утворення і розкладу
одного. Проте останнім часом
руйнування
Мал. 33. Озоновий шар
вих «дір». Однією з причин цього явища є хімічні реакції між озоном і речовинами промислового походження.
манітні заходи, спрямовані на збереження озонового шару. За матеріалами з інтернету з’ясуйте, які речовини руйнують озоновий шар.

пам'ятати,

За матеріалами з інтернету довідайтеся про озонування води — сучасний спосіб її знезараження перед спрямуванням у водогін. З’ясуйте, які переваги має цей спосіб порівняно з хлоруванням води.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про просту речовину Оксигену — озон.
Сформулюйте цікаве


виявилася:
більшою за
використаного кисню; б) меншою за масу використаного кисню; в) такою самою, що й маса використаного кисню. Укажіть правильну відповідь. 2.
просторі. Вона зберігає всі хімічні елементи, з яких складається її мінлива жива і мінеральна природа. Багато речовин зазнають фізичних і хімічних змін. Частина цих змін має циклічний характер; вони відбуваються «по колу».
Дізнаєтеся, зрозумієте, використаєте Яка суть колообігів кисню та Оксигену в природі? У чому полягає біологічна роль кисню? Які сфери застосування кисню?
Повітря. Кисень є компонентом повітря — природної

Намалюйте або за допомогою комп’ютера створіть діаграму складу повітря, використавши значення об’ємних часток газів (табл. 2).
За діаграмою складу повітря (за об’ємом1), яке видихає людина, обчисліть відношення в ньому об’ємів кисню і вуглекислого газу.


Обчисліть також відношення об’ємів цих газів у повітрі, яке ми вдихаємо (табл. 2), і порівняйте обидва відношення.
Що трапиться, якщо об’ємна частка кисню в повітрі зменшиться; збільшиться?
Колообіг кисню. Ви знаєте, що кисень міститься не лише в атмосфері, а й у гідросфері (розчинений у воді). Між обома «сферами» нашої планети триває безперервний обмін киснем: незначна його кількість розчиняється в річках, морях, океанах і стільки ж виділяється з води в повітря (мал. 35).
Сукупність процесів у природі, унаслідок яких речовина постійно переходить з одного середовища в інше, називають колообігом речовини. У природі відбувається колообіг води. Назвіть його складники.

Оксигену. Кожної миті

трапляється
фізичних і хімічних явищ. Серед них є такі, що періодично
утворення кисню (фотосинтез, розклад
сфери);
витрачання кисню (дихання, хімічні реакції з речовинами в природі, технологічних процесах, під час пожеж, згоряння палива і пального);
взаємоперетворення «кисень — озон»;
взаємоперетворення оксигеновмісних речовин.
Схема 2 Колообіг Оксигену
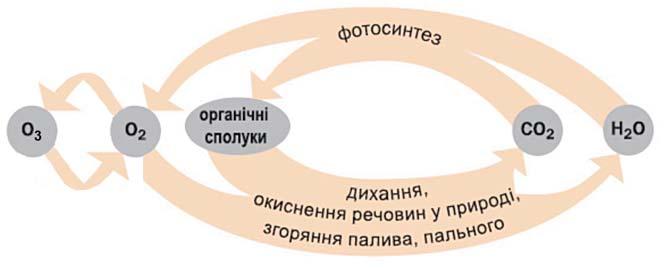
Важливим процесом, унаслідок якого утворюється кисень, є фотосинтез. Він відбувається в зеленому листі рослин на сонячному світлі за участю вуглекислого газу, який міститься в повітрі, води і деяких речовин із ґрунту. Зелений пігмент рослин хлорофіл поглинає енергію світлових променів і передає її речовинам, які взаємодіють між собою. Продуктами фотосинтезу є органічні речовини, які накопичуються в рослинах, і кисень, що надходить в атмосферу (мал. 36). Спрощена схема цього процесу: h CО2 + H2O органічні речовини + O2. (глюкоза, крохмаль та ін.)


та тканини, де взаємодіє
різними органічними речовинами, зокрема й отриманими з їжею. Продукти цих реакцій необхідні організму для нормального розвитку. Частина хімічних перетворень за участю кисню відбувається з виділенням теплоти, завдяки чому підтримується постійна температура тіла. Застосування кисню. Кисень застосовують у різних галузях і у великій кількості. У металургії цей газ прискорює процес виплавляння сталі, покращує її якість. Кисень необхідний у виробництві багатьох речовин. Його використовують у спеціальних пристроях
різання і зварювання металів. Без балонів, наповнених газовими сумішами, які містять кисень, не можуть працювати космонавти, пожежники, водолази, військові льотчики. Кисневі подушки застосовують у разі деяких захворювань для полегшення дихання. За допомогою зрідженого кисню створюють необхідні умови для згоряння пального в космічних ракетах. Широке використання має й кисень, який міститься в повітрі. За його участю згоряє паливо на теплоелектростанціях, пальне у двигунах автомобілів, випалюють руди на заводах кольорової металургії, здійснюють інші технологічні процеси.

Створіть ментальну карту
ВИОКРЕМЛЮЄМО

кисню».
3.
4.* Обчисліть масу кисню в повітрі об’ємом 10 л, якщо густина повітря становить 1,29 г/л. Додаткові відомості, необхідні для розв’язання задачі, візьміть із таблиці 2.
Аналізуймо
5. Уміст вуглекислого газу в повітрі протягом останніх
7.* Визначте,
8. Підготуйте за матеріалами
людина
Оберіть найкращий варіант. Формуймо словничок

Пожежі — не єдине хімічне явище за участю кисню, яке завдає шкоди людству. З одним із таких явищ зіткнулися ще давні римляни (адже слово «корозія» прийшло до нас з латинської мови). Напевно, їх неабияк дивувало руйнування міцних виробів із заліза. Вони назвали це явище «роз’їданням» металу.
Дізнаєтеся, зрозумієте, використаєте
Яке явище називають корозією?
Які хімічні перетворення зумовлюють корозію металів?
На чому ґрунтується захист металів від корозії?
Корозія металів. Ви часто стикаєтеся з металевими предметами, які змінили свій попередній вигляд. Вироби з деяких металів поступово втрачають характерний блиск. Залізо іржавіє, тобто вкривається пухким бурим нальотом. Причиною цих змін є реакції металів з киснем, водою (у рідкому й газуватому станах), розчиненими
Речовини довкілля діють

сліди корозії.
Розглянемо хімічні реакції, які відбуваються під час корозії кількох металів.
Залізо, перебуваючи в повітрі, повільно реагує з киснем і водою (або парою). Унаслідок корозії металу утворюється


із трьома речовинами: киснем, водою (або парою) і вуглекислим газом, що є в повітрі. Продукт реакції — сполука, яка має формулу (CuOH)2CO3. Вона утворюється
також бронзи — сплаву міді з оловом, у вигляді зеленкувато-блакитного порошкоподібного нальоту1 (мал. 38).






Хімічних змін зазнає й срібло.
Ваші рідні знають, що срібні прикраси і столові набори з часом темнішають (мал. 39). Причиною цього є взаємодія металу з киснем і сірководнем, незначна домішка якого міститься в повітрі.
Продукти реакції — сполука Аргентуму із Сульфуром Ag2S (тверда речовина темно-коричневого кольору) і вода.


Складіть хімічне рівняння корозії срібла.
Швидкість корозії срібла надзвичайно мала. Протягом сотень років предмети, вироблені з цього металу, не втрачають ужиткових властивостей.
Не кородують лише найпасивніші метали, серед яких — золото і платина. Золото, яке утворилося в земній корі мільярди років тому, залишилося незмінним, хоча контактувало з багатьма природними речовинами. Беручи
не лише ювелірні прикраси,
клад, електричні
що
тривалого часу. Не зазнає корозії
титан,
«металом космічної ери». Він є одним із найважливіших конструкційних матеріалів для ракетної техніки. Із титану виготовляють труби і ємності, стійкі до хімічно активних речовин. Титановими пластинками покрито поверхню деяких монументів.

За матеріалами з інтернету з’ясуйте, для чого використовують титан у медицині.
Захист металів від корозії. Відомі різні способи запобігання корозії металів. Найпростіший з

спортної техніки, різних виробів із заліза.
Метал можна вкрити шаром іншого, стійкішого до корозії металу — нікелю, хрому (мал. 40), золота. Цей процес здійснюють у заводських умовах, здебільшого — з використанням електричного струму і хімічних реакцій. Нікельовані та хромовані деталі є в транспортних засобах, приладах, устаткуванні.

Мал.
Алюміній і хром є стійкими до речовин довкілля, бо мають на поверхні хоча й тонку, непомітну, але міцну й хімічно інертну плівку оксиду (Al2O3, Cr2O3). Ця плівка утворюється в разі контакту металу з повітрям1, коли алюміній чи хром тільки-но виплавлено або в процесі його оброблення. Шар оксиду, який має аналогічні властивості, можна створити на поверхні інших металів, зокрема заліза, за допомогою хімічних реакцій.
су судна шматок металу, хімічно активнішого
залізо (наприклад, цинку чи магнію). Доки весь цей метал не окисниться, залізо не іржавітиме. Те саме відбувається з оцинкованою жерстю (але не лудяною, тобто вкритою оловом), з якої виготовляють покрівлю, різні ємності, металеві листи і



Мал. 41.

1. Фізичним чи хімічним явищем є корозія металу?
2. Який найуживаніший метал кородує найбільшою мірою, а які метали не зазнають корозії?
3. Назвіть способи захисту металів від корозії, які ґрунтуються на використанні хімічних реакцій.
Аналізуймо
4. Чим можна пояснити те, що залізо майже не трапляється в природі?
Поміркуймо
5. Придивіться до металічної решітки газової плити, на яку ставлять каструлі, сковорідки, або до дверцят пічки. Опишіть, що відбувається з металом і його поверхнею.
6. Чому у великих містах, промислових центрах корозія
10.
словничок
11. Випишіть ключові слова і словосполучення

виготовленим розчином кухонної солі з її масовою
з повітрям) та накрийте їх.
Вміст першої та четвертої
Наші воїни захищають рідну землю в будь-яку пору року, за будь-якої погоди. Буває, що взимку, восени чи навесні, коли холодно, навіть невеличке вогнище розпалити не можливо. Напевно, ви вже знаєте, що в таких випадках часто використовують хімічні грілки. Вони всередині містять суміш порошку заліза, кухонної солі, наповнювачів, а також воду. У разі контакту суміші цих речовин з повітрям починається хімічна реакція з виділенням теплоти. Отже, трохи зігрітися можна і без вогню.
Дізнаєтеся, зрозумієте, використаєте Як класифікують
У чому причина теплового ефекту реакції? Для чого використовують екзотермічні реакції?
ефекти хімічних реакцій. Ми вже розглядали хімічні реакції, під час яких відбувається горіння простих і складних речовин. Якщо сірку або метан підпалити в повітрі або кисні,
ділятиметься теплота: t S + O2 = SO2; t CH4 + 2O2 = CO2 + 2H2O.
Теплота може виділятися і внаслідок реакцій, які не супроводжуються горінням. Таку особливість має, наприклад, взаємодія негашеного вапна з водою; продукт реакції — гашене вапно: CaO + H2O = Ca(OH)2.
Реакції з виділенням теплоти часто відбуваються мимовільно. Щоправда, у більшості
ініціювати (наприклад, підпалити речовину чи нагріти до температури займання). За перебігом такого перетворення (назва досліду — «Хімічний вулкан») ви вже спостерігали (с. 20, вправа 6). А реакція алюмінію
в момент контакту речовин.
за покликанням у QR-коді (https://h8.academiabook.club/ p-14-video.html).

певна кількість енергії. Потім атоми Гідрогену
води з атомів відбувається з виділенням енергії, але іншої її кількості,
водню і кисню. Різниця значень цих енергій і становить тепловий ефект хімічної реакції. З виділенням чи поглинанням теплоти реагує водень з киснем? Кількість якої

руйнування
Чому хімічній реакції властивий тепловий ефект? Кожна речовина має свою внутрішню енергію, яку виміряти неможливо. Вона складається з енергій усіх частинок речовини (атомів, молекул) та енергії їх взаємодії. Якщо сумарна внутрішня енергія реагентів перевищує внутрішню енергію продуктів, реакція відбувається з виділенням теп-
під час яких теплота поглинається, — ендотермічними2 . Назвіть біологічні та

терміни, у яких є префікси екзо- і ендо-.
Для теплового ефекту реакції
ба читати «дельта-аш»). Великою грецькою
зміну
матичну дію: сумарна внутрішня
t S + O2 = SO2; Н < 0 (екзотермічна реакція); t CaCO3 = CaO + CO2; Н > 0 (ендотермічна реакція).

Запишіть у зошит інші хімічні рівняння, наведені на с. 69, і додайте до кожного з них позначення теплового ефекту.
Про термохімічні рівняння із числовими значеннями теплових ефектів реакцій ви можете дізнатися за покликанням у QR-коді (https://h8.academiabook.club/p-14text-1.html).
Використання теплових ефектів реакцій. У давні часи

text
люди обігрівали своє житло, спалюючи деревину, рослинні залишки. В останні кілька століть людина почала використовувати для цього вугілля, продукти перероблення нафти, природний газ. Речовини та їх суміші, які ми спалюємо з метою вироблення теплової енергії, називають паливом. Поясніть, чому під час згоряння різних

різна
деревина. Водень називають
єдиним продуктом його реакції з киснем є вода. Горіння водню — «безкарбоновий»
Проте водень як паливо не використовують,
процесів одержання, а також зберігання і транспортування водню (він скраплюється за дуже низької температури), можливість вибуху сумішей водню з повітрям від іскри або підпалювання. Екзотермічні реакції ми використовуємо в побуті (в газових плитах, камінах, печах), спалюючи пальне у двигунах автомобілів, влаштовуючи святкові феєрверки. Ранньої весни дехто вирощує розсаду овочів на «теплових» грядках — ділянках, де компостуються рослинні залишки і внаслідок хімічних реакцій, спричинених

поширених харчових продуктів
кликанням у QR-коді (https://h8.academiabook.club/p-14text-2.html).
ВИОКРЕМЛЮЄМО ОСНОВНЕ

Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про тепловий ефект хімічної реакції, екзотермічні та ендотермічні реакції.

Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям.
реакції?
2. Чи є вичерпним поділ хімічних реакцій на екзотермічні та ендотермічні?
Поміркуймо 3. За стандартних умов
два оксиди — CaO і CO2. Продукт реакції — речовина з формулою CaCO3. Екзотермічною чи ендотермічною є ця реакція? Візьміть до уваги вміщені в параграфі відомості про протилежну реакцію — розклад речовини СаСО3.
4.* Екзотермічними чи ендотермічними є, на вашу думку, реакції, які зумовлюють корозію металів? Відповідь аргументуйте.

Експериментуємо в хімічному кабінеті/лабораторії
ДОСЛІДЖУЄМО ТЕРМІЧНИЙ РОЗКЛАД ХАРЧОВОЇ
Харчова сода під час нагрівання розкладається. Одним із продуктів реакції є вуглекислий газ.
Виконуючи дослід, дотримуйтеся правил безпеки!
Помістіть у пробірку харчову соду масою приблизно 2 г і закрийте корком, у який вставлено зігнуту газовідвідну трубку. Налийте в невелику склянку води до половини об’єму.
Перевірте зібраний прилад на герметичність.
Запаліть спиртівку або сухе пальне.
Закріпіть пробірку в пробіркотримачі і вставте кінець газовідвідної трубки у воду. Обережно прогрійте всю пробірку, а потім нагрівайте її нижню частину, де міститься сода. Спостерігайте за надходженням пухирців газу у воду. Спочатку виділятиметься невелика кількість повітря (поясніть, чому), а потім вуглекислий газ.
Припиніть нагрівання. Чи продовжує розкладатися сода?
Коли пухирці газу вже не з’являтимуться, одразу знову нагрівайте пробірку із содою. Що відбувається?
Тільки-но завершите дослід, вийміть газовідвідну трубку з води (поясніть, для чого).
Зробіть висновок за результатом експерименту.
Доведіть, що газ, який виділяється, є вуглекислим газом1. Для цього занурте газовідвідну трубку в пробірку з розчином гашеного вапна і ще раз нагрійте
Коли на присадибній ділянці збирають урожай, порівнюють, скільки відер картоплі посадили і скільки відер накопали. Яйця купують не на вагу чи поштучно, а зазвичай десятками. Коли з’ясовуємо, скільки маємо зимового чи літнього взуття, то кажемо — стільки-то пар. У кулінарному рецепті читаємо: «До суміші інгредієнтів додайте дві столові ложки оцту». Отже, у побуті ми користуємося різними мірами. У хімії мірою для речовин, крім одиниць вимірювання маси (грама, кілограма) та об’єму (мілілітра, літра), є моль1 .
Дізнаєтеся, зрозумієте, використаєте
У чому суть фізичної величини «кількість речовини»?
Скільки найменших частинок речовини містить її порція в 1 моль?
Як обчислюють і для чого використовують кількість речовини?
Коментуючи реакцію
4Li + O2 = 2Li2O,
ви скажете, що кожні чотири
молекулою кисню. Для здійснення цього досліду потрібно використати такі порції обох речовин, щоб відношення
частинок N(Li) : N(O2) становило 4 : 1. Але
хімії
фізичну величину
речовини. Її позначають латинською літерою n. Одиниця вимірювання цієї величини — моль. Кількість речовини пов’язана з кількістю найменших частинок. У порції речовини в 1 моль міститься надзвичайно багато частинок — 602 000 000 000 000 000 000 000 атомів або молекул. Це число можна записати як 602 · 1021 (21 — кількість

32 г. Упевнені, що ви здогадалися: 7 — значення відносної
маси Літію, а 32 — значення відносної молекулярної маси кисню.

Іноді щодо малих порцій речовин використовують іншу одиницю вимірювання кількості речовини — мілімоль. Яке кількісне відношення моля і цієї одиниці?
Повернімося до хімічного рівняння, наведеного на початку параграфа. Згідно з ним кожні 4 моль літію реагують з 1 моль кисню й утворюється 2 моль літій оксиду: 4Li + O2 = 2Li2O.
4 моль 1 моль 2 моль
Отже, кількості речовини реагентів і продуктів відповідають (або пропорційні) коефіцієнтам у хімічному рівнянні.
Уявлення про кількості речовини в 1 моль вам допоможе сформувати малюнок 44.


Мал. 44.
речовини в 1 моль: алюміній (27 г); вода (18 см3); кухонна сіль (58,5 г)
Моль — одна із семи основних одиниць вимірювання міжнародної системи SІ. Які інші основні одиниці вимірювання вам відомі?
Поняття «кількість речовини» використовують не лише щодо речовин, а й щодо окремих частинок — атомів, молекул.
Число 6,02 · 1023 в мільярди разів перевищує кількість волосин на головах, у вусах, бородах усіх людей, які живуть на Землі. Якщо вкрити земну поверхню такою кількістю тенісних м’ячиків, то товщина

газів. Відкрив один із законів для газів (1811), згодом названий його іменем. Уточнив атомні маси деяких елементів, визначив склад молекул води, амоніаку, метану, сірководню, вуглекислого і чадного газів, деяких інших сполук. Запропонував експериментальні методи визначення молекулярних мас газоподібних речовин.
Працюємо разом
Виведемо формулу для обчислення кількості речовини
що порція речовини містить N молекул. Міркуємо так: в 1 моль речовини міститься NA молекул, в n моль речовини
Задача 1.
Обчислити кількість речовини алюмінію, якщо зразок цього металу містить 3,01 · 1024 атомів.
Дано: N(Al) = 3,01 · 1024 атомів
Відповідь: n(Al) = 5 моль. n(Al) — ?
Розв’язання Скористаємося формулою, яка відображає зв’язок між кількістю речовини і кількістю частинок (атомів): N(Al) 3,01 · 1024 n(Al) = ———— = —————————— = NA 6,02 · 1023 моль–1
30,1 · 1023 = —————————— = 5 моль. 6,02 · 1023 моль–1
В 1 моль будь-якої речовини молекулярної будови завжди міститься більше ніж 1 моль атомів. Наприклад, в 1 моль кисню О2 — 2 моль атомів Оксигену, а в 1 моль
атомів Гідрогену, або 5 моль усіх атомів.

Скільки всіх атомів
0,1 моль?
Задача 2. Обчислити
B2O3, якщо кількість речовини оксиду становить 4 моль.
n(B) — ? n(O) — ?
Дано: n(B2O3) = 4 моль Розв’язання У формулі оксиду B2O3 є два атоми Бору і три атоми Оксигену. Тому оксид кількістю речовини 1 моль містить 2 моль атомів Бору і 3 моль атомів Оксигену. У 4 моль цієї сполуки кількості речовини
n(B) = 2 · n(B2O3) = 2 · 4 моль = 8 моль; n(O) = 3 · n(B2O3) = 3 · 4 моль = 12 моль.
Відповідь: n(B) = 8 моль; n(O) = 12 моль.
n(С) : n(H) = 1 : 4.
об’єму, а й певної кількості речовини.
Узявши до уваги важливість для хімії фізичної величини «кількість речовини», наукова спільнота запровадила День Моля — 23 жовтня (тобто 23.10), з 6-ї год 02 хв ранку до 6-ї год 02 хв вечора (мал. 46).
ВИОКРЕМЛЮЄМО ОСНОВНЕ Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про кількість речовини в хімії, одиницю її вимірювання та спосіб обчислення.

Сформулюйте цікаве
ставте його своїм

Мал. 46. День Моля
2. Що означають записи NA і Na?
3. Укажіть кількості речовини атомів кожного хімічного елемента (усно): а) в 1 моль брому Br2; б) у 2 моль сірководню H2S; в) в 1/3 моль фосфіну PH3.
4. Запишіть
а) 3,01 · 1023 молекул;
б) 12,04 · 1023 атомів Оксигену.
6. Виконайте обчислення і заповніть таблицю:
N(H3PO4) 12,04 · 1023
n(H3PO4), моль
n(H), моль
n(P), моль
n(O), моль
7.* Обчисліть кількість речовини метану СН4, у якій міститься стільки атомів, скільки їх: а) в 1 моль оксиду P2O3; б) у 0,3 моль кислоти HNO3.
Поміркуймо
8. Назвіть відношення кількостей речовини хімічних елементів у речовинах із такими формулами: СаО, MgF2, HClO4, Fe(OH)3.
У команді
9. Прокоментуйте хімічні реакції, використавши поняття «моль»: а) S + 2Cl2 = SCl4; б) N2 + 3H2 = 2NH3; в) 2H2O2 = 2H2O + O2.
Дізнаєтеся, зрозумієте, використаєте У чому суть величини «молярна маса»?
Як обчислювати значення молярних мас простих і складних речовин? Як використовують молярні маси у розв’язуванні задач?
Важливою величиною, яка пов’язана з кількістю речовини, є молярна маса. Її використовують у багатьох обчисленнях, готуючись до хімічного експерименту, під час упровадження технологічних процесів на заводах, опрацювання результатів дослідження хімічних реакцій та ін.
Молярну масу позначають латинською
ній масі. Для того щоб
речовини, достатньо вказати значення відповідної відносної
дати розмірність — г/моль:
Ar(С) = 12 => M(C) = 12 г/моль; Mr(Cl2) = 71 => M(Cl2) = 71 г/моль; Mr(H2S) = 34 => M(H2S) = 34 г/моль.


Обчисліть і запишіть
молярних мас амоніаку NH3 і карбаміду CO(NH2)2.
Запропонуйте алгоритм обчислення мас атома Алюмінію і молекули води.
Працюємо разом
речовини і молярною масою.
m M = —— n
Працюємо разом
Розглянемо два способи
молярні маси. Один спосіб передбачає складання пропорції,
Задача 1.
Обчислити кількість речовини метану СH4,
сполуки становить 6,4 г.
Дано:
m(СH4) = 6,4 г
n(СH4) — ?
Розв’язання
1-й спосіб
1. Обчислюємо молярну масу сполуки: M(СH4) = M(С) + 4M(H) = =12 г/моль + 4 · 1 г/моль = 16 г/моль.
2. Обчислюємо кількість речовини метану складанням пропорції: 1 моль СH4 має масу 16 г, х моль СH4 — 6,4 г; 1моль 16 г ———— = ———; x моль 6,4 г 1 моль · 6,4 г х = n(СH4) = ———————— = 0,4 моль. 16 г
2-й спосіб Скористаємося однією з формул, наведених у параграфі: m(СH4) 6,4 г n(СH4) = ————— = —————— = 0,4 моль. M(СH4) 16 г/моль
Відповідь: n(СH4) = 0,4 моль.

Задача 2.
Обчислити масу заліза, яка відповідає кількості речовини металу 1,5 моль.
Дано: n(Fe) = 1,5 моль
m(Fe) — ?
Розв’язання
1-й спосіб
Залізо — проста речовина, яка складається з атомів елемента Феруму.
M(Fe) = 56 г/моль.
Обчислюємо масу заліза складанням пропорції: 1 моль Fe має масу 56 г, 1,5 моль Fe — х г;
1,5 моль · 56 г х = m(Fe) = ———————— = 84 г. 1 моль
2-й спосіб
Скористаємося однією з формул, наведених у параграфі:
m(Fe) = n(Fe) · M(Fe) = = 1,5 моль · 56 г/моль = 84 г.
Відповідь: m(Fe) = 84 г.
Задача 3. Обчислити масу 1 · 1024 атомів Натрію.
Дано: N(Na) = = 1 · 1024 атомів
m(Na) — ?
Розв’язання
1-й спосіб Оскільки M(Na) = 23 г/моль, то 1 моль атомів Натрію має масу 23 г. Пам’ятаючи, що 1 моль хімічного елемента — це 6,02 · 1023 його атомів, складаємо пропорцію й розв’язуємо її: 6,02 · 1023 атомів Na мають масу 23 г, 1 · 1024 атомів Na — х г; 1 · 1024 · 23 г x = m(Na) = ——————— = 6,02 · 1023
230 г = ———— = 38,2 г. 6,02
2-й спосіб
1. Обчислюємо кількість речовини Натрію: N(Na) 1 · 1024 n(Na) = ———— = ————————— = NA 6,02 · 1023 моль–1
10 моль = ————— = 1,66 моль. 6,02
2. Обчислюємо масу атомів Натрію: m(Na) = n(Na) · M(Na) = = 1,66 моль · 23 г/моль = 38,2 г.
Відповідь: m(Na) = 38,2 г.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті

1. Узгодьте записи в лівому
чику:
1) Mr(CO2); а) 44 г; 2) m(CO2); б) 44 г/моль; 3) M(CO2); в) 44; г) 44 моль.
2. Обчисліть
такі формули: F2, H2O, SO2, Li2O, Mg3N2, H2SO4, NaOH. (Усно.)
3. Маса сполуки кількістю речовини
6. Скільки молекул і скільки атомів
г? (Усно.)
7. Де міститься більше молекул і більше усіх атомів (усно): а) в 1 г оксиду CO чи в 1 г оксиду NO; б) у 2 моль води чи в 1 моль кислоти H2SO4?
8. Обчисліть масу 1023 молекул глюкози С6Н12О6. У команді
9. Ви маєте свинцевий, мідний і алюмінієвий кубики. Довжина ребер кожного кубика становить 1 см. У якому кубику міститься найбільше атомів, а в якому — найменше? Необхідні відомості про властивості (які саме?) цих металів відшукайте в інтернеті.
10.* З’ясуйте за допомогою обчислень, у воді чи спирті С2Н5ОН міститься більше молекул, якщо однаковими є: а) маси рідин; б) об’єми рідин. Необхідні відомості про
тернеті.
Формуймо словничок
11. Випишіть ключові слова
укладання двомовного словничка.
Оцінюймо свої знання
12. Створіть
речовини.
значення молярного об’єму (наприклад, алюміній — 10 см3/моль, кухонна сіль — 27 см3/моль, вода — 18 см3/моль, етиловий спирт — 58 см3/моль). Молярні об’єми речовин у твердому і рідкому станах, як і їхні густини, майже не залежать від температури і тиску.

Підтвердьте за допомогою обчислення, що молярний об’єм води становить 18 см3/моль.
Гази внаслідок нагрівання або зниження тиску істотно розширюються, а внаслідок охолодження або підвищення тиску стискуються. Це зумовлено тим, що відстані між
газах дуже великі (у твердих і рідких речовинах найменші частинки контактують одна з одною). У разі зміни умов змінюються густина газу і
молярний об’єм.
вказуючи значення цих
відповідні температуру і тиск. Дослідники встановили, що молярний об’єм різних газів за однакових
22,4 л.
Насправді об’єми газів кількістю речовини 1 моль незначною мірою різняться. Наприклад, об’єм 1 моль водню становить за нормальних умов 22,42 л, метану — 22,3 л, сірчистого газу — 21,9 л. Відмінності зумовлені слабким взаємним притяганням молекул у газі, яке залежить від складу і форми цих частинок.
Зв’язок між об’ємом (V), кількістю речовини (n) і молярним об’ємом (VM) описує формула V = n · VM.

Спробуйте самостійно вивести цю формулу.
об’ємах різних газів, яка ґрунтувалася
у 1811 р. А. Авогадро. Отримавши подальше експериментальне
стала законом.

N(H2) = N(O2) = N(CO2) n(H2) = n(O2) = n(CO2)
Працюємо разом
об’єм газу.
Мал. 47.
Однакові кількості
молекул і кількості
речовини в однакових об’ємах газів
Наведені та обчислені об’єми, густини і молярні
відають нормальним умовам.
Задача 1. Обчислити об’єм водню масою 0,4 г.
Дано:
m(H2) = 0,4 г Розв’язання
1. Обчислюємо кількість речовини водню: m(H2) 0,4 г n(H2) = ———— = ————— = 0,2 моль. M(H2) 2 г/моль
2. Обчислюємо об’єм водню складанням пропорції: 1 моль Н2 займає об’єм 22,4 л, 0,2 моль Н2 — х л; х = V(Н2) = (0,2 моль · 22,4 л) : 1 моль = 4,48 л. Об’єм
і
відповідною формулою (с. 87): V(Н2) = n(Н2) · VM = = 0,2 моль · 22,4 л/моль = 4,48 л. V(H2) — ? Відповідь: V(H2) = 4,48 л. Обчисліть масу

становить 1,12 л.
Задача 2. Обчислити кількість молекул у
N(O2) — ?
Дано: V(O2) = 1 л Розв’язання 1-й спосіб Обчислюємо кількість молекул кисню в газі об’ємом 1 л складанням пропорції: у кисні об’ємом 22,4 л — 6,02 · 1023 молекул, а об’ємом 1 л — х молекул; 1 л · 6,02 · 1023 x = N(O2) = ———————— = 22,4 л = 0,27 · 1023 = 2,7 · 1022 (молекул).
2-й спосіб Обчислюємо кількість молекул
N V n = —— і n = — NA VM
отримуємо таку: NA · V N = ——— . VM
Здійснюємо обчислення: 6,02 · 1023 моль–1 · 1 л N = ——— = 22,4 л/моль = 0,27 · 1023 = 2,7 · 1022 (молекул).
Відповідь: N(O2) = 2,7 · 1022 молекул.
Цю задачу можна розв’язати ще одним способом. Спочатку обчислюють за відповідними формулами кількість речовини кисню, а потім — кількість молекул.
Задача 3. Обчислити густину чадного газу CO.
Дано: СО Розв’язання 1.Обчислюємо молярну масу чадного газу: M(CO) = 28 г/моль.
2. Обчислюємо густину газу: 1 моль СО, тобто 28 г, займає об’єм 22,4 л, х г СО — 1 л; (СО) — ?
28 г · 1 л х = m(CO) = ———— = 1,25 г; 22,4 л
(СО) = 1,25 г/л.
Густину чадного газу можна обчислити й іншим способом:
M
M = · VM => = —— ; VM
M(СО) 28 г/моль (СО) = —— = —— = 1,25 г/л. VM 22,4 л/моль
Відповідь: (СО) = 1,25 г/л.


Густина газу Х становить 1,43 г/л. Обчисліть молярну масу цього газу.
2.
1) V(H2); а) 22,4 г; 2) m(H2); б) 22,4 л;
3) VM(H2); в) 22,4 моль; г) 22,4 л/моль.
4. Густина
9.
словничок 12.
Дізнаєтеся, зрозумієте, використаєте
У яких об’ємних відношеннях реагують і
газуваті речовини? Як використовують закон об’ємних відношень газів у розв’язуванні задач?
Згідно із законом Авогадро, однакові об’єми
кількість молекул (за однакових умов — температури й тиску). Якщо кожна молекула одного газу реагує з однією
іншого, наприклад у реакції
умови кількість молекул чадного газу
молекул кисню (на це вказує хімічне рівняння).
Узагальненням зроблених висновків
зів у хімічних реакціях, який відкрив французький науковець ЖозефЛуї Гей-Люссак у 1808 р.:
об’єми газів, які взаємодіють між собою та утворюються внаслідок реакції, відносяться як
цілі числа. Згодом з’ясувалося, що ці числа є відповідними коефіцієнтами в хімічних рівняннях. Отже, для газів у реакціях (1) і (2) V(H2) : V(Cl2) : V(HCl) = 1 : 1 : 2; V(CO) : V(О2) : V(CО2) = 2 : 1 : 2.


Французький фізик і хімік, член і президент Паризької академії наук. Відкрив закон теплового розширення газів за постійного тиску (1802), закон об’ємних відношень газів у хімічних реакціях (1808). Досліджував склад повітря, галогени, сполуки галогенів. Удосконалив методи хімічного аналізу. Винайшов кілька наукових приладів і промислових пристроїв.
Працюємо разом
Розглянемо приклад розв’язування задачі
використанням закону об’ємних відношень газів у хімічних реакціях.
Задача.
Обчислити об’єм азоту, який прореагує з воднем об’ємом 600 мл, і об’єм амоніаку NH3, що утвориться внаслідок реакції.
Дано: V(H2) = 600 мл Розв’язання
1. Складаємо рівняння реакції: N2 + 3H2 = 2NH3.
Згідно з хімічним рівнянням і законом об’ємних відношень газів, один об’єм азоту взаємодіє з трьома об’ємами водню й утворюються два об’єми амоніаку.
2. Обчислюємо об’єм азоту складанням пропорції: 1 мл азоту прореагує з 3 мл водню, х мл азоту

перетворення, якщо всі реагенти та продукти реакцій є газами:
а) CH4 + Cl2 CH3Cl + HCl; г) O3 O2; б) NH3 + Cl2 N2 + HCl; д) N2 + O2 NO; в) CH4 C2H2 + H2; е) N2H4 NH3 + N2?
2. Чи вистачить кисню
газу?
Розв'язуймо задачу
3. Обчисліть об’єм кисню, який
4. У посудині змішали газ NO об’ємом 4 л і кисень об’ємом 3 л. Які
5. Після реакції у 40 мл суміші кисню з воднем залишилося 10 мл кисню, який не прореагував. Обчисліть об’єми
6.
У команді
9. За матеріалами з інтернету
менти, що зумовили відкриття
10. Випишіть
свої
барвні кульки, наповнені легким газом — воднем або гелієм. Водень раніше використовували метеорологи, запускаючи в повітря кульки з цим газом і закріпленими датчиками. У першій половині ХХ ст. воднем наповнювали дирижаблі, якими транспортували різні вантажі, а також перевозили людей. Водень — легкозаймистий газ, а його суміш з повітрям від іскри вибухає. Це спричинило катастрофу великого дирижабля в 1937 р. і скоротило використання водню в різних сферах.
Важчий за повітря вуглекислий газ накопичується в деяких печерах. Таке явище іноді призводить до загибелі людей, які опиняються в цих місцях, через зупинку дихання.
Ті, хто працює в лабораторіях, на заводах, у транспортній галузі,
DH2(O2) = 16.


взяти порції кисню і водню об’ємами по 22,4 л за нормальних умов, то маси газів (у грамах) чисельно дорівнюватимуть їхнім молярним або відносним молекулярним масам. Узявши це до уваги обчислимо відносну густину кисню за воднем: M(O2) Mr(O2) 32 DH2(O2) = —— = — — = —— = 16. M(H2) Mr(H2) 2
Перетворимо всі наведені вище формули
значимо

величину називають середньою молярною масою
тря. Її значення перебуває в проміжку між числами 32 і 28 — відносними





ється вгору?
Працюємо разом
Розглянемо приклади розв’язування
користаємо відносну густину газу.
Задача 1.
Обчислити відносні густини вуглекислого газу за воднем і за повітрям.
Дано: CO2
DH2(CO2) — ?
Dпов.(CO2) — ?
формулами:
M(CO2) 44 г/моль DH2(CO2) = —— = — — = 22. M(H2) 2 г/моль
M(CO2) 44 г/моль
Dпов.(CO2) = —— = — — = 1,52. M(пов.) 29 г/моль
Відповідь: DH2(CO2) = 22; Dпов.(CO2) = 1,52.
M(B) = DA(B) · M(A).
Задача 2.
Відносна густина газу Х (сполука Сульфуру) за воднем становить 17. Обчислити молярну масу газу Х і встановити його хімічну формулу.
Дано:
DH2(X) = 17 X — сполука Сульфуру
М(X) — ?
Розв’язання
1. Обчислюємо молярну масу газу Х: M(Х) = DH2(Х) · M(Н2) = 17 · 2 г/моль = 34 г/моль.
2. Установлюємо хімічну формулу газу Х, який є сполукою Сульфуру.
Оскільки M(S) = 32 г/моль, а M(Х) = 34 г/моль, то в молекулі Х міститься лише один атом Сульфуру. На інший елемент у молярній масі Х «залишається» 34 г/моль – 32 г/моль = 2 г/моль. Очевидним є те, що цей елемент — Гідроген, і його атомів у молекулі Х — два: 2М(Н) = 2 · 1 г/моль = 2 г/моль.
Отже, формула газу Х — Н2S.
Відповідь: M(Х) = 34 г/моль; Х — Н2S.

Поміркуймо
3.
4. Відносна густина за воднем
5. Укажіть напрямок переміщення в повітрі: а) газу хлору Cl2, який використовували в хімічних атаках у Першій світовій війні; б) газу амоніаку NH3 в разі аварії на хімічному заводі.
Аналізуймо
6. Один зі способів збирання газу в хімічному досліді — витиснення ним повітря з посудини. Оберіть варіант розміщення пробірки (мал. 49), у яку збиратимете:
а) вуглекислий газ;
б) водень; в) метан CH4.
Пояснюймо
7. Чому відносна густина суміші газу етилену С2Н4 з чадним газом СО не залежить від її кількісного складу?
Розв'язуймо задачу
8. Обчисліть густину повітря за нормальних умов.
9. Відносна густина газу А за
Мал. 49. Варіанти збирання газу в пробірку
які маси речовин прореагували. У наш час без урахування мас чи об’ємів речовин виконують лише прості досліди, щоб дізнатися, відбувається реакція чи ні, а також з’ясувати особливості взаємодії речовин. Експерименти, спрямовані на одержання певної кількості продукту реакції або витрачання певної кількості реагента, завжди доповнюють обчисленнями — попередніми чи підсумковими.
Дізнаєтеся, зрозумієте, використаєте Як використовують маси та кількості речовини реагентів і продуктів, а також об’єми газів у розв’язуванні задач?
Обчислення мас, кількостей речовини реагентів і продуктів реакцій, об’ємів газів, які взаємодіють
утворюються, виконують за хімічними рівняннями. Для цього використовують значення відносних атомних, молекулярних мас або молярних мас. На підставі результатів обчислень дослідники/дослідниці, технологи/технологині цілеспрямовано здійснюють хімічні перетворення і одержують необхідні маси продуктів реакцій, уникаючи надлишку і втрат реагентів.
Працюємо разом
Розглянемо приклади розв’язування задач з використанням хімічних рівнянь. Нагадуємо, що коефіцієнти в хімічних рівняннях указують на відношення кількостей речовини реагентів і продуктів реакцій: 4P + 5O2 = 2P2O5; 4 моль 5 моль 2 моль n(P) : n(О2) : n(P2О5) = 4 : 5 : 2.
Задача 1. Обчислити
Дано: n(S) = 0,6 моль Розв’язання 1. Складаємо хімічне рівняння: 2Al + 3S = Al2S3. n(Al2S3) — ?
Згідно з рівнянням, з кожної порції сірки кількістю речовини 3 моль утворюється сполука Al2S3 кількістю речовини 1 моль.
2. Готуємо запис для складання пропорції. Указуємо під формулами сірки і сполуки Al2S3 їхні кількості речовини згідно з коефіцієнтами в хімічному рівнянні (3 моль і 1 моль відповідно), а над формулами — наведену в умові задачі кількість речовини сірки (0,6 моль) і невідому кількість речовини сполуки Al2S3 (х моль):
0,6 моль х моль 2Al + 3S = Al2S3. 3 моль 1 моль
3. Обчислюємо кількість речовини сполуки Al2S3. Складаємо пропорцію і розв’язуємо її: за рівнянням реакції із 3 моль S утворюється 1 моль Al2S3, за умовою задачі із 0,6 моль S — х моль Al2S3;
3 моль 1 моль = —— ; 0,6 моль x моль 0,6 моль · 1 моль х = n(Al2S3) = —— = 0,2 моль. 3 моль
Відповідь: n(Al2S3) = 0,2 моль.
Задача 2.
Обчислити масу магнію, який прореагував з киснем, якщо маса одержаного оксиду MgO становила 16 г.
Дано:
m(MgО) = 16 г
m(Mg) — ?
Розв’язання
1-й спосіб 1. Складаємо хімічне рівняння: 2Mg + О2 = 2MgО.
Згідно з рівнянням, кількості речовини магнію і оксиду однакові, наприклад 2 моль Mg і 2 моль MgО.
2. Записуємо молярні маси магнію і оксиду: М(Mg) = 24 г/моль; М(MgO) = 24 г/моль + 16 г/моль = 40 г/моль.
3.
4.
2 · 24
Mg утворюється 2 · 40 г MgО, за умовою задачі із х г Mg — 16 г MgО; 2 · 24 г 2 · 40 г = —— ; х г 16 г
2 · 24 г · 16 г х = m(Mg) = —— = 9,6 г. 2 · 40 г
2-й спосіб
1. Складаємо хімічне рівняння: 2Mg + О2 = 2MgО.
2. Обчислюємо кількість речовини оксиду: m(MgO) 16 г n(MgO) = —— = — — = 0,4 моль. M(MgO) 40 г/моль
3. Згідно з коефіцієнтами в хімічному рівнянні, кількість речовини магнію, що реагує з киснем, така сама, що й оксиду, який утворюється. Отже, n(Mg) = n(MgО) = 0,4 моль.
4. Обчислюємо масу магнію: m(Mg) = n(Mg) · M(Mg) = = 0,4 моль · 24 г/моль = 9,6 г. Відповідь: m(Mg) = 9,6 г.

Дано:
n(H2O2) = = 0,3 моль
V(O2) — ?
Розв’язання
1. Записуємо хімічне рівняння і готуємо запис для складання пропорції:
0,3 моль x моль 2H2О2 = О2 + 2H2O. 2 моль 1 моль
2. Обчислюємо кількість речовини кисню. Складаємо пропорцію і розв’язуємо її: із 2 моль H2О2 утворюється 1 моль О2, із 0,3 моль H2О2 — х моль О2; 0,3 моль · 1 моль х = n(О2) = —— = 0,15 моль. 2 моль
3. Обчислюємо об’єм кисню: V(О2) = n(О2) · Vм = = 0,15 моль · 22,4 л/моль = 3,36 л.
Відповідь: V(O2) = 3,36 л.

Мідь можна одержати за реакцією оксиду CuО з воднем. Обчисліть масу оксиду і об’єм водню, які взаємодіють, якщо утворюється мідь масою 16 г.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у
у зошиті висновки

х л 1 моль в) СО2 + 2KOH = K2СО3 + H2O; 44,8 л х г г) SО2 + CaО = CaSO3.
2. Обчисліть кількість речовини сполуки FeCl3, яка утворилася внаслідок взаємодії заліза з хлором Cl2 кількістю речовини 0,1 моль.
3. Реакція відбувається згідно з рівнянням А + 3Б = 2В + 3Г. Які кількості речовини В і Г утворяться, якщо прореагує: а) 0,1 моль А; б) 6 моль Б? (Усно.)
4. Обчисліть масу оксиду CaO, яка утворилася після спалювання кальцію масою 10 г. (Усно.)
5. Обчисліть об’єм сірчистого газу SО2, який було одержано спалюванням сірки масою 16 г. (Усно.)
Розв'язуймо задачу
6. Обчисліть кількість речовини кисню, який прореагував з оксидом NO, якщо утворився оксид NO2 об’ємом 5,6 л.
7. Після повного термічного розкладу крейди CaCO3 утворилися оксид CaO кількістю речовини 0,15 моль і вуглекислий газ. Обчисліть масу
немає домішок.
8. Обчисліть сумарний
одержаних унаслідок розкладу електричним струмом води кількістю
ріях, здійснюють на заводах, демонструють
і університетах.
Дізнаєтеся, зрозумієте, використаєте
Які типи речовин є реагентами і продуктами в реакціях сполучення?
Які речовини називають сульфідами?
Однією з характеристик, за якими класифікують хімічні реакції, є кількість реагентів і продуктів. Вам уже відомі два типи реакцій, які різняться цим показником, — реакції сполучення і реакції розкладу. Реакції сполучення за участю кисню. З киснем, переважно за нагрівання, реагує більшість металів і неметалів (§ 8). Магній у разі підпалювання горить у повітрі сліпучо-білим полум’ям, сірка — блідо-блакитним полум’ям, а в чистому кисні — яскравим (мал. 24):
t 2Mg + O2 = 2MgO; t S + O2 = SO2.
Алюміній взаємодіє з киснем повітря
Al2O3.

Якщо
Складіть рівняння цієї хімічної реакції.
реакції з пробірки або колби по тоненькій трубочці, то він горітиме дуже блідим полум’ям, яке можна й не помітити.


Змоделюйте в зошиті або на комп’ютері реакцію
чаної
t, k 2SО2 + О2 = 2SО3.

Чи всі оксиди можуть реагувати з киснем? Якщо ні, то коли взаємодія оксиду з киснем неможлива? Візьміть до уваги склад (хімічні формули) оксидів.
Реакції простих речовин з іншими неметалами. З металами і неметалами реагує також сірка. Ці реакції відбуваються внаслідок нагрівання. Якщо сірку розплавити і пропускати над нею водень, то речовини взаємодіятимуть з утворенням газу сірководню, який має запах «тухлих яєць». Його хімічна формула подібна до формули води. Складіть рівняння реакції сірки

За приклад реакції сірки з
нагріти суміш, то в певний
реакція, яка супроводжуватиметься сильним розігріванням речовин. Спостерігати
у QR-коді (https://h8.academiabook.club/p-21-video-1.html).
Рівняння реакції: t Fe + S = FeS.
Сполуки металічних елементів із

сульфідами. Реагентами в багатьох реакціях сполучення є фтор (найактивніший неметал), хлор, бром та інші неметали.
Суміш водню з газом фтором вибухає в темряві за стандартних умов, а з газом хлором — у разі освітлення. Бром взаємодіє з воднем під час нагрівання. Продукти цих реакцій утворені двоáтомними молекулами. Складіть відповідні хімічні рівняння. За реакцією хлору з міддю



ють вапно. Реакція сполучення між трьома речовинами відбувається, коли іржавіє залізо (§ 12). У регіонах, де переважають вапнякові гірські породи, вапняк
CaCO3 + H2O + CO2 = Ca(HCO3)2.
Оксиди і сульфіди в природі. Літосфера багата на мінерали,
і
кристалів (мал. 29, 50).





Мал.
Україні є понад пів сотні родовищ залізних руд. Найбільше родовище розташоване в Криворізькому басейні. Марганцеві руди зосереджені в Нікопольському басейні та
За запасами залізних і марганцевих руд Україна посідає 1-ше місце в Європі. Видобуток залізних руд у нашій країні становить 4 % від світового, а марганцевих — 10 %.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про реакції сполучення, участь у них металів, неметалів, складних речовин, а також про оксиди і сульфіди.

Сформулюйте цікаве запитання за темою параграфа і поставте його своїм
оцінка саме така.
їх. Поясніть, чому
H2SO4, Ag2S, HgO.
2.
4. Обчисліть об’єм кисню (за нормальних умов), який взаємодіє з фосфором масою 6,2 г, якщо формула продукту реакції — Р2О5.
Аналізуймо
5.* Суміш цинку і сірки нагрівали до завершення взаємодії речовин. Продуктом реакції є сульфід ZnS. Чи залишилася після досліду частина реагенту (якого?), якщо в суміші містилися: а) однакові маси простих речовин; б) однакові кількості речовини реагентів?
У команді
6. За відомостями в інтернеті з’ясуйте, з якими простими речовинами взаємодіють золото і срібло. Переконайтеся, що ці метали є хімічно пасивними.
Дізнаєтеся, зрозумієте, використаєте
Які чинники впливають на перебіг хімічної реакції? Як змінюється швидкість реакції залежно від умов її здійснення?
У чому полягає керування хімічними перетвореннями речовин?
Швидкість хімічної реакції. Одні хімічні реакції відбуваються миттєво (наприклад, вибух суміші метану з повітрям), інші — досить швидко (горіння речовин), деякі — повільно (багато реакцій розкладу). Процес взаємодії речовин характеризують, використовуючи величину, яку називають швидкістю хімічної реакції. В однорідній суміші реагентів швидкість реакції визначають за зміною кількості речовини реагенту або продукту в суміші об’ємом 1 л за 1 с. Ми не будемо обчислювати швидкість реакцій, а зазначатимемо, збільшується чи зменшується швидкість реакції в разі зміни умов, за яких вона відбувається. Звісно, швидкість реакції залежить від самих реагентів, їхньої хімічної активності. Наприклад, якщо
а мідь підпалити

іншим реагентом тим активніше, чим більша його концентрація (частинки реагентів частіше стикаються одна з одною). У разі взаємодії газів реакції прискорюються

Унаслідок цього збільшується кількість активних зіткнень частинок реагентів, що зумовлює збільшення швидкості реакції. Як нагрівання впливає на розклад гідроген пероксиду Н2О2, ви з’ясували, виконавши експеримент (с. 38).

Коли свіже молоко швидше скисає — восени чи влітку?
Вплив каталізатора на швидкість реакції. Те, що каталізатор пришвидшує реакцію, ви зафіксували після додавання оксиду MnO2 в розчин гідроген пероксиду (с. 37). Іншим каталізатором цієї реакції є речовина FeCl3. Якщо додати невелику порцію її бурого розчину до розчину Н2О2, починається інтенсивне виділення кисню, а забарвлення рідини не змінюватиметься (мал. 52). Отже, речовина FeCl3, як і MnO2, під час розкладу гідроген пероксиду не витрачається.

Іноді каталізатор спричиняє певне хімічне перетворення. На заводах з виробництва азотної кислоти перша стадія технологічного процесу ґрунтується на взаємодії амоніаку з киснем за наявності каталізатора. Один із продуктів цієї реакції — оксид NO — є реагентом на другій стадії процесу: 2NO + O2 = 2NO2. Якщо каталізатор не використовувати, то замість оксиду NO утвориться азот
які необхідно здійснити. Якщо, наприклад, реагент чи продукт реакції може окиснитися киснем повітря, то взаємодію речовин здійснюють у реакторі, заповненому вуглекислим газом, азотом чи аргоном.

Ви одержуватимете газ взаємодією між розчинами двох реагентів. Як забезпечите перебіг реакції з потрібною швидкістю, використовуючи прилад, зображений на малюнку 53?
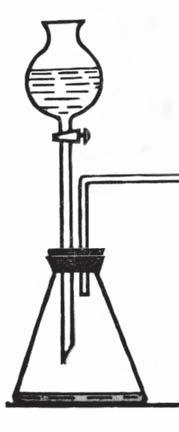
Мал. 53.
На керування хімічними реакціями в атмосфері за участю озону спрямовані заходи зі збереження озонового шару (§ 10). Вони полягають у контролі країн за виробництвом та використанням озоноруйнівних речовин. У § 12 розглянуто способи запобігання корозії металів. Каталізатори у двигунах внутрішнього згоряння (мал. 54) унеможливлюють утворення продуктів неповного згоряння пального, які забруднюють повітря. У виробництві вин для зупинення процесу бродіння виноградного соку в нього пропускають сірчистий газ. З метою поліпшення умов для фотосинтезу
сади овочевих культур,
стадіонів (мал. 55).
N2, O2, CO2, H2O, CnHm, CO

Мал. 54.
N2, O2, CO2, H2O

Мал. 55.

харчової промисловості часто додають невелику кількість речовин-консервантів (мал. 56), що збільшує термін зберігання продуктів. Ці добавки мають бути безпечними для людини. З інформацією про те, як уникнути швидкого псування харчових продуктів, тобто унеможливити реакції їхніх компонентів з киснем і водою, ви можете ознайомитися за покликанням у QR-коді (https://h8.academiabook.club/ r-1-p-22.html).
ВИОКРЕМЛЮЄМО ОСНОВНЕ

text
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про швидкість хімічної реакції, залежність її
різних чинників,

чина такої відмінності?
6. Чому для приготування овочевих страв часто
приготування багатьох страв рекомендують певні інтервали значень температури. Чому багато людей обирають найнижчу температуру в цьому інтервалі?
8. Чому компот з ягід доцільно варити 15 хв, а не 30 чи 40 хв? Аналізуймо
9. Як можна уповільнити
11. Складіть двомовний
з параграфів 12—21, і об'єднайте його
словничком до параграфів 4—11. Отримаєте словничок
ника.
Оцінюймо свої знання
12. Створіть у зошиті таблицю оцінювання ваших знань і заповніть її.
13. Виконайте розміщені за QR-кодом або покликанням (https://learningapps.org/display?v=p37n7bjf324) завдання за матеріалом параграфів 12—21. test

Бурхливий розвиток хімічної науки в
завдяки відкриттю
хімії. Спираючись на нього, дослідники
в
десятки раніше невідомих хімічних елементів, пояснили багато фактів, спрогнозували та обґрунтували закономірності у світі речовин. Після того як було з’ясовано, що атоми мають складну будову, періодичний закон отримав потужну теоретичну підтримку. Виявилося, що хімічний характер елементів і властивості речовин залежать від кількості електронів у атомах, їхньої енергії, здатності атомів втрачати або приєднувати електрони.
Періодичний закон використовують у своїй діяльності не лише хіміки, а й фізики, геологи, біологи, фахівці, які працюють у суміжних із хімією наукових напрямах.
Суть періодичного закону розкриває періодична таблиця хімічних елементів. Вона — джерело інформації для всіх, хто вивчає хімію, досліджує речовини та їх перетворення.
Дізнаєтеся, зрозумієте, використаєте
Як виникли і формувалися уявлення про хімічний елемент? На чому ґрунтувалися спроби класифікації хімічних елементів?
Розвиток уявлень про хімічний елемент. Давньогрецькі філософи вважали, що всі речовини складаються з чотирьох елементів-першоначал — вогню, повітря, води і землі. На їхню думку, ці «стихії» є носіями певних якостей, притаманних речовинам, — теплоти, холоду, вологості й сухості. Таких поглядів дотримувалися й алхіміки. Термін «елемент», який за змістом наближався до сучасного, виник у науці в XVII ст. Англійський хімік Роберт Бойль назвав елементом те, що є межею розкладу речовини. Якби ми жили тоді, то розуміли б під елементом атом.
Французький науковець Антуан-Лоран Лавуазьє
просту речовину, оскільки її неможливо розкласти
інші речовини. Однак відомо, що не розкладається чимало складних речовин, наприклад оксиди SiO2, Al2O3, а проста речовина озон легко перетворюється на іншу — кисень: 2О3 = 3О2. Не розрізняв елемент і просту речовину англійський дослідник Джон Дальтон. На межі ХІХ—ХХ ст. фізики встановили, що атом складається з позитивно зарядженого ядра і негативно заряджених електронів. Відтоді почали визначати хімічний елемент як вид атомів з певним зарядом ядра. Нині, характеризуючи якісний склад води, восьмикласник/восьмикласниця скаже, що ця речовина складається з молекул, які містять атоми двох видів (із зарядами ядер +1 і +8). Отже, вода є сполукою


для металів?
Серед металів і серед неметалів були речовини, дуже подібні між собою. Хіміки об’єднали їх у родини, які отримали такі назви: лужні метали, галогени, інертні гази.
Лужні метали. Це — літій, натрій, калій, рубідій, цезій, францій. Вони легкі, м’які (мал. 57), легкоплавкі, виявляють дуже високу хімічну активність (мал. 58). Перебуваючи в повітрі, лужні метали швидко взаємодіють з киснем і водяною парою, тому їх зберігають у гасі в герметично закритих посудинах (мал. 59) або ампулах, з яких видалено повітря. Зазначені





одержати за реакцією металу натрію з неметалом хлором. Назва «галогени» походить від грецького слова «галос» — сіль.
Інертні гази. Ці прості речовини — гелій, неон, аргон, криптон, ксенон і радон — було відкрито в другій половині ХІХ ст. Їх назвали інертними газами, оскільки вони не взаємодіяли з жодною речовиною. У минулому столітті дослідники виявили, що криптон, ксенон і радон реагують з найактивнішим неметалом фтором. Тому було запропоновано іншу назву інертних газів — благородні гази.


Назва неіснуючої планети, на якій народився герой коміксів Супермен,
планету творці цих коміксів?
Гелій спочатку виявлено на Сонці
нашій планеті.
Інертні (благородні) гази складаються не з молекул, як інші гази, а з атомів.
Хімічні елементи, які утворюють розглянуті родини простих речовин, мають аналогічні загальні назви:
елементи, галогени, інертні елементи.
Li, Na, K Ca, Sr, Ba S, Se,
першої тріади: Ar(Li) + Ar(K) 7 + 39 ———————— = ———— = 23 = Ar(Na). 2 2
Крім того, властивості простої речовини та сполук цього елемента виявилися «проміжними» порівняно з властивостями простих речовин і сполук двох сусідніх елементів у тріаді.

Обчисліть напівсуму відносних атомних
і порівняйте її зі значенням відносної атомної маси Брому.
Сформувати
H Li Be B C N O F Na Mg Al Si P S Cl K Ca Cr Ti Mn Fe
і восьма ноти мають
майже однакове.

Укажіть у наведеному ряду хімічні елементи, подібні до Калію.
Закономірність, виявлену Ньюлендсом, назвали правилом октав. Вона спостерігалася на початку ряду елементів, але далі порушувалася (мал. 61). Наприклад, Манган не був подібним до Фосфору, а Ферум — до Сульфуру. Число 8, як свідчить історія хімічної науки, спочатку вважали якимось магічним, але після з’ясування будови атома воно отримало наукове
(розділ 3). Ще одну спробу класифікації хімічних елементів здійснив у

Значення валентності** IVIIIIIIIII …………Li 7,03(Be 9,3?) C 12,0N 14,04O 16,00Fl 19,0Na 23,05Mg 24,0 Si 28,5P 31,0S 32,07Cl 35,46K 39,13Ca 40,0 …As 75,0Se 78,8Br 79,97Rb 85,4Sr 87,6
Sn 117,6Sb 120,6Te 128,3I 126,8Cs 133,0Ba 137,1
Pb 207,0Bi 208,0……(Tl 204?)…
валентність хімічних елементів ітиметься в розділі 3.

Укажіть стовпчики з елементами-галогенами і лужними елементами.
Розглянуті спроби науковців здійснити класифікацію хімічних елементів охоплювали лише їх частину, але створили передумови для відкриття періодичного закону.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про спроби класифікації хімічних елементів. Сформулюйте цікаве запитання

3.
хімічних елементів: властивості простих речовин, поширеність елементів у природі, склад характерних сполук, значення відносних атомних мас.
Проаналізуйте твердження.
І. Є хімічні елементи, які утворюють лише прості речовини.
ІІ. Галогени — загальна назва кількох хімічних елементів, а також кількох неметалів.
Чи є з-поміж них правильні?
А. Правильне лише І
Б. Правильне лише ІІ
В. Обидва правильні
Г. Немає правильних
Аналізуймо
4. Порівняйте ряд елементів Ньюлендса з їх послідовністю в періодичній таблиці та вкажіть відмінності.
5.* Відкоригуйте речення, наведене у Вікіпедії: Лужні метали
менти
У команді
6. Чому, на ваш погляд, не запропоновано впорядкувати хімічні
Дізнаєтеся,
Відкриття періодичного закону. Проблема
хімічних елементів зацікавила в 60-ті роки
ст. дослідника Дмитра Менделєєва. Його пошуки були спрямовані на виявлення закономірностей і взаємозв’язків, які охоплювали б усі елементи, а не лише їх частину. Узявши за основу, як Ньюлендс і Маєр, маси атомів, дослідник розмістив усі відомі на той час
атомних
елементи і т. д. Отже, хімічний характер елементів у ряду періодично повторюється.

Які зміни в природі можна охарактеризувати словом «періодичність»? Порівняйте за змістом це слово зі словами «неперервність», «сталість», «поступовість».
Складений ряд містив подібні фрагменти (їх називають періодами). Першим у кожному фрагменті був типовий металічний елемент (лужний), а останнім — типовий неметалічний елемент (галоген). Наводимо два сусідні фрагменти
Li Be B C N O F Nа Mg Al Si P S Cl
відрізняється від оксиду Магнію. Силіцій, Фосфор, Сульфур і Хлор|— неметалічні елементи. Хімічна активність неметалів, утворених цими елементами, зростає; найактивнішим серед них є хлор.

Відшукайте в інтернеті інформацію про взаємодію натрію і магнію з водою, а також сірки і хлору з воднем. Переконайтеся, що натрій хімічно активніший за магній, а хлор хімічно активніший за сірку.
Один із висновків зі щойно викладеного такий: металічний характер елементів у кожному фрагменті їхнього ряду посилюється справа наліво, а неметалічний характер — зліва направо: металічний неметалічний характер елементів характер елементів
Na Mg Al
Ряд хімічних елементів, складений
Si P S Cl
збільшенням відносних атомних мас, було названо природним рядом, тобто таким, що існує незалежно від людини в природі.
Закономірності, виявлені в природному ряду хімічних елементів, зумовили відкриття в 1869 р. періодичного закону, або закону періодичності. Наводимо перше формулювання закону: властивості хімічних елементів, простих речовин, а також склад і
сполук перебувають у періодичній
характеру елементів,

ває єдність хімічних елементів, взаємозв’язок між ними і становить фундамент хімічної науки. Вивчаючи хімію, ви часто звертатиметеся до цього закону, знайдете нові факти, які підтверджують його, зможете передбачати хімічні властивості простих і складних речовин, імовірність перебігу реакцій за їх участю.
ВИОКРЕМЛЮЄМО
Проаналізувавши матеріал, викладений

5.
додають до формулювання
реакціях і використовують
задач. Періодичний закон не має математичної підтримки.
лиця, яка є в цьому та інших
кабінетах/лабораторіях, аудиторіях і
хімічних факультетів університетів.
Дізнаєтеся, зрозумієте, використаєте
Яку структуру має періодична таблиця?
Як користуватися коротким і довгим варіантами періодичної таблиці?
Періодична таблиця — джерело відомостей про хімічні елементи.
періодичної таблиці. Періодична таблиця хімічних елементів складається з рядків (періодів) і стовпчиків (груп).
Період — фрагмент природного ряду
лужного елемента1 до інертного.
Кожний варіант періодичної таблиці має сім періодів. У довгому варіанті періодом є один рядок таблиці, а в короткому — один чи два сусідні рядки. Перший період, другий і третій називають малими періодами, а четвертий, п’ятий, шостий і сьомий — великими. Періоди нумерують арабськими цифрами. Група

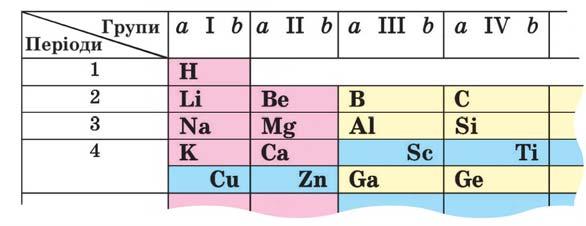

а
Елементи Германій, Стибій і Полоній, що розміщені поблизу цієї лінії, утворюють прості речовини, які за одними властивостями подібні до металів, а за іншими — до неметалів. У головних підгрупах (форзац І)


Мал. 63.
Один із корпусів університету UNAM, м. Мехіко
наукових установ (мал. 63). Нею іноді
призначення (мал. 64).

Мал. 64. Текстильний виріб
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про періодичну таблицю хімічних елементів та її структуру.
Сформулюйте цікаве запитання за

5. Запишіть у зошит інформацію
6. Заповніть таблицю:
Хімічний елемент
Порядковий номер
Розміщення в короткому варіанті періодичної таблиці символназваперіодгрупапідгрупа C
7.
Назвіть хімічні елементи, які розміщені: а) у 2-му періоді, V групі; б) у 5-му періоді, IV групі, головній підгрупі; в) у 6-му періоді, VIII групі, побічній підгрупі. Для кожного елемента вкажіть порядковий номер. У яких групах перебувають ці елементи в довгому варіанті періодичної таблиці? Аналізуймо
8. Серед наведених чисел укажіть ті, які є порядковими
талічних елементів і неметалічних елементів: 1, 6, 11, 16, 20, 30, 35.
9. За розміщенням Брому, Магнію, Мангану і Селену в періодичній таблиці визначте, металічним чи неметалічним є кожний елемент. У команді
10. Порівняйте періодичну таблицю, яка є в хімічному кабінеті/лабораторії, де ви навчаєтесь, із таким самим варіантом таблиці на форзаці підручника. Якщо є відмінності між ними, укажіть їх. 11. Назвіть два елементи, найбільш подібні до: а) Стронцію;
Фосфору; в) Стануму; г) Хлору.
Формуймо словничок
12. Випишіть ключові слова і словосполучення з тексту параграфа для укладання двомовного словничка.
13. Складіть двомовний словничок із ключових слів і словосполучень, виписаних вами з параграфів 22—24. Оцінюймо свої знання
14. Створіть у зошиті таблицю оцінювання ваших знань і заповніть її.
15. Скориставшись набутими знаннями, розв’яжіть розміщений за QR-кодом або покликанням (https:// learningapps.org/display?v=p2ym31xon25) кросворд.

16. Виконайте розміщені за QR-кодом або покликанням (https://learningapps.org/display?v=pvis58non24) завдання за матеріалом параграфів 22—24. test crossword

Уявлення
сприймали
уки. Вони вважали атоми монолітними невидимими частинками, які не можна зруйнувати. Наприкінці ХІХ ст. і в першій третині ХХ ст. під час складних фізичних експериментів було встановлено, що атом є сукупністю ще дрібніших частинок.
Дізнаєтеся, зрозумієте, використаєте Які моделі атома відображають його будову? Як визначають кількісний склад атома?
Еволюція моделей атома. У 1897 р. англійський фізик Джозеф-Джон Томсон відкрив електрон1. Маса електрона виявилася майже у 2000 разів меншою за масу найлегшого з атомів — атома Гідрогену. Заряд електрона становить –1 (в одиницях вимірювання заряду елементарних частинок).
Оскільки атом електронейтральний, то в ньому, крім негативно заряджених електронів, має бути «щось» із позитивним зарядом. Узявши це до уваги, Томсон у 1904 р. припустив, що атом є суцільною однорідною субстанцією з позитивним зарядом, у якій розподілені електрони (мал. 65, а
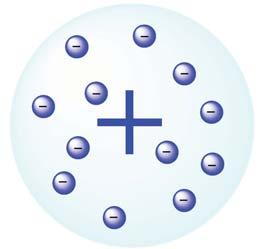
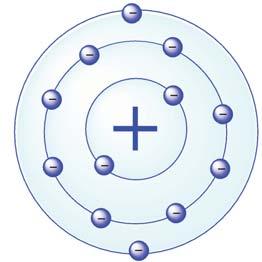

заряд електронів такий самий, що й
ядра.
ядра в десятки тисяч разів менший від радіуса атома. Відоме таке порівняння: якщо атом збільшити до розмірів стадіону, то ядро за розмірами
нагадуватиме зернину.
Електрони утримуються в атомі електростатичними силами; маючи негативний заряд, вони притягуються до позитивно зарядженого ядра. Проте електрони не падають на ядро, бо рухаються
данський
атома.



назвапозначення
мірою нагадують гравітаційні, завдяки яким
має певну вагу, тобто зазнає земного тяжіння.
Кількісний склад атомів. Оскільки атом електронейтральний, то кількість протонів у ньому дорівнює кількості електронів (мал. 66). Ця кількість збігається з порядковим номером хімічного елемента.
1. Укажіть кількість протонів та електронів в атомах Гідрогену і Карбону.


2. Модель атома якого хімічного елемента зображено на малюнку 65, б?
3. Назвіть хімічний елемент, атом якого має стільки електронів, скільки планет у Сонячній системі.
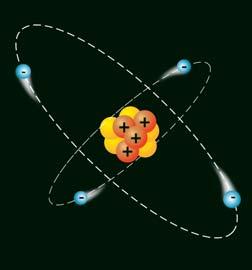
Сумарну кількість протонів і
в атомі називають нуклонним числом. Його позначають літерою А (не плутайте з позначенням відносної атомної маси Ar): А = N(p+) + N(n0).
9 4 Be
Значення нуклонного числа записують верхнім індексом ліворуч від символу хімічного елемента: 9Ве. Кількість нейтронів в атомі дорівнює різниці між нуклонним і протонним числами.

Скільки нейтронів в атомі Берилію?
Берилій є серед двадцяти хімічних елементів, атоми кожного з яких мають однакові нуклонні числа (вони
збігаються з відносними атомними масами):
Be, F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi.
В атомах будь-якого іншого елемента може бути різна кількість нейтронів; ці атоми різняться нуклонними числами, а отже, й масою.

Визначте кількості нейтронів в атомах Флуору і Натрію.
Підсумуємо все викладене
рази. Атом містить однакову кількість протонів і електронів, яка дорівнює порядковому
N(p+) = N(е–) = Z.


Перевірмо себе
1. Які частинки є складниками
склад атомного ядра?
2. Яких частинок у будь-якому атомі однакова кількість?
3. Чи існують атоми, у яких немає:
8*. Укажіть у переліку хімічний елемент,
кількість нейтронів: Sc, As, Mn.
9. Назвіть хімічний елемент, в атомі якого містяться 42 заряджені частинки.
Розв’язуймо задачу
10. Обчисліть кількість електронів, які містяться в
Формуймо словничок
Оцінюймо
Можемо почути відповідь: «Теж 118, бо хімічний елемент — вид атомів з певною кількістю протонів. Наприклад, в атомі елемента № 1 Гідрогену міститься один протон, а в атомі елемента № 118 Оганесона — 118 протонів». Насправді ж видів атомів значно більше, ніж хімічних елементів. Чому більше — зараз з’ясуємо.
Дізнаєтеся, зрозумієте, використаєте
Який зміст термінів «ізотопи» і «нукліди»?
Як обчислюють відносну атомну масу за ізотопним складом хімічного елемента?
Чому поняття «відносна атомна маса» і «відносна молекулярна маса» потребують уточнення?
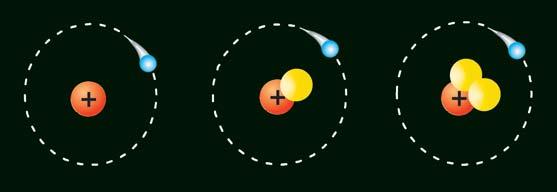
в лабораторії
мента з двома нейтронами в ядрах. Такий, штучний, вид атомів
гену названо Тритієм.

За відомостями з інтернету з’ясуйте походження
пів Гідрогену.
Нуклонні числа (суми
Гідрогену становлять 1, 2 і 3. Отже, ізотопи — це види атомів хімічного елемента з різними нуклонними числами.
Речовини, утворені ізотопами хімічного елемента, незначною мірою різняться фізичними властивостями. Густина «важкої» води, яка складається з молекул D2O, становить 1,104 г/см3, а температура кипіння (за нормального тиску) — +101,43 ºС. Аналогічні фізичні характеристики звичайної
Нуклідами
новить майже 2300.

Запишіть повні позначення нуклідів Нітроген-14 і Ферум-56.


вчетверо більше, ніж легких.
Помітне відхилення значення відносної атомної маси хімічного елемента від цілого числа вказує на наявність у нього кількох природних ізотопів. Наприклад, Купрум (Ar = 63,546) має два ізотопи (63Cu і 65Cu), Цинк (Ar = 65,38) — п’ять (64Zn, 66Zn, 67Zn, 68Zn і 70Zn), а Станум (Аr = 118,71) — десять (найлегший ізотоп серед них — 112Sn, а найважчий — 124Sn).
За відомостями з інтернету дізнайтеся,

на і молекулярна маси є відношеннями мас атома й молекули до 1/12 маси атома Карбону. Але Карбон має три

Перевірмо себе
1. Які види атомів називають ізотопами і нуклідами? Наведіть приклади позначень цих видів атомів.
2. Укажіть пропущене словосполучення в реченні «Нуклідів хімічного елемента … його ізотопів»: а) більше, ніж; б) стільки, скільки; в) менше, ніж.
3. Скільки протонів, нейтронів і електронів міститься в
20Nе, 21Nе, 40K, 40Са, 192Pt?
Аналізуймо
4. У природі існують два нукліди Гідрогену (1Н, 2Н) і три нукліди Оксигену (16О, 17О, 18О). Визначте, скільки є різновидів молекули води. Напишіть їхні хімічні формули з позначенням нуклідів (на зразок 1Н2Н16О). Скільки значень
6.
що Бром повинен мати лише один природний нуклід 80Br. Однокласниця припустила наявність ізотопів у Брому. З чиєю думкою ви погоджуєтеся? Для перевірки висловлених гіпотез відшукайте відповідну інформацію в інтернеті.
Розв’язуймо задачу
7. Ізотопи Магнію, які є в природі, — 24Mg, 25Mg та 26Mg. Атомна частка першого нукліда становить 78,7 %, а другого — 10,1 %. Обчисліть відносну атомну масу Магнію з точністю до десятих. 8.* Галій має
то помітите, що значення відносних
елементів містяться в дужках. Такі записи означають, що всі нукліди цих елементів є нестійкими. Наявне в дужках значення відносної атомної маси елемента є нуклонним числом його ізотопу, який розпадається найповільніше.
Дізнаєтеся, зрозумієте, використаєте
Які види атомів називають радіонуклідами?
Де використовують радіонукліди і яку небезпеку вони становлять?
Радіоактивність. Ядра атомів деяких хімічних елементів можуть мимовільно розпадатися на менші ядра (стійкі або нестійкі) та окремі частинки — складники атомів (мал. 69). Це супроводжується виділенням енергії та виникненням особливого електромагнітного випромінення.


Мал. 69. Розпад ядра нукліда Радію
тинки, тривалість «життя» яких становила частки секунди. Очевидно, існує межа стійкості атомів. Але коли її буде досягнуто? І чи станеться це взагалі? Скільки хімічних елементів ще буде відкрито? Дослідники/дослідниці не знають відповідей на ці запитання.

Хімічного елемента № 43 Технецію немає на Землі; його ізотопи радіоактивні. Чому, на вашу думку, елементу дали таку назву?
Деякі радіоактивні ізотопи трапляються в природі (наприклад, Карбон-14 — у живих організмах, Калій-40 — у мінералах і гірських породах), але в мізерній кількості. Вони дуже повільно розпадаються і не шкодять рослинам, тваринам, людині. Використання радіонуклідів. Радіоактивні ізотопи застосовують у хімії, біології, археології, сучасній техніці, а також у фізичних експериментах з метою одержання атомів нових хімічних елементів. У медицині за допомогою радіонуклідів опромінюють злоякісні

якого містить
значте цей нуклід і назвіть його.
Самочинне перетворення ядер атомів супроводжується виділенням великої кількості енергії. Важливою сферою використання радіоактивних ізотопів є атомна енергетика. Необхідні умови її розвитку — надійність реакторів та обладнання на атомних електростанціях, а також максимальна безпека людей. Атомні електростанції в Україні виробляють майже половину

Мал. 70.

Мал. 71.




кількість розведеного розчину сполуки Йоду (така сполука
солі). За відомостями з інтернету з’ясуйте: 1) яку функцію виконує Йод в організмі;
2) якому процесу запобігає надходження в організм Йоду з рекомендованого препарату.
Дотепер у зоні, прилеглій до ЧАЕС, заборонено проживати людям. Над зруйнованим реактором зведено захисну споруду, за станом якої здійснюють постійний контроль. Частина території України, яка була забруднена радіонуклідами, поступово відновлюється природним шляхом.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши

Перевірмо себе
1. Чому хімічних елементів, відкритих
2. Які частинки називають радіонуклідами?
3. У чому суть радіоактивного розпаду атомів?
Дізнаваймося
4. За відомостями з інтернету з’ясуйте, які радіоактивні ізотопи виконують функцію палива в атомних електростанціях.
Поміркуймо
5. Дехто
7. Підготуйте повідомлення
Дізнаєтеся,
атома потребувала коригування? Однакову чи різну енергію мають електрони в атомі?
Який запис називають електронною формулою атома?
Особлива природа електрона. Атомні орбіталі. Електрон має електричний заряд, масу, енергію, а потік електронів, що виділяються з радіоактивної речовини, подібний за своїми характеристиками до світлових променів. Визначити траєкторію руху електрона, його координати у просторі неможливо. Він може перебувати в атомі будь-де з різною ймовірністю (мал. 73).
Частину простору в атомі, де перебування електрона є найбільш імовірним, називають орбіталлю.

Мал. 73. Місця перебування електрона в атомі Гідрогена
Орбіталь з електроном подібна до мікроскопічної хмари (іноді використовують термін «електронна хмара»), у якій розподілений негативний заряд частинки.
Орбіталі різняться своєю формою1. Найпростіша серед них — сферична форма (мал. 74); у центрі такої орбіталі розміщене ядро атома.
Цю орбіталь позначають літерою s. Другий різновид форми — гантелеподібна (мал. 75). Її має р-орбіталь. Такі орбіталі зорієнтовані в атомі перпендикулярно одна до одної вздовж
осей координат х (позначення — px-орбіталь), у (py-орбіталь) і z (pz-орбіталь). Є ще d- і f-орбіталі складніших форм.

Мал. 74. Сферична орбіталь (s-орбіталь) x y z
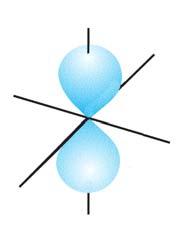

є
в орбіталі один електрон, його називають неспареним, а якщо їх два — спареними.
Енергія електронів в атомі. Найважливішою характеристикою електрона, яку можна визначити майже точно, є його енергія. Електрони розподіляються в атомі так, щоб їхня енергія була найменшою. Це — принцип «мінімальної енергії»; він визначає електронну будову атомів. Що компактніша орбіталь і
зі ще більшою і т. д. Аналогічною моделлю можна проілюструвати однакові й різні потенціальні енергії таких фізичних тіл, як книжки, що зберігаються на полицях у шафі (мал. 76).
Енергетичні рівні складаються з підрівнів; номер рівня вказує на кількість підрівнів. Так, перший рівень має один підрівень, другий — два, третій — три і т. д. (схема 4).
Розподіл електронів за енергетичними рівнями. Кожний енергетичний рівень містить обмежену кількість електронів. Їхню максимальну кількість визначають за формулою Nmax(e–) = 2n2 ,
де n — номер рівня.
s

Номер
енергетичного рівня

Кількість електронів в орбіталі
Мал. 77. Електронна формула атома 1s1
Тип орбіталі
Атом якого хімічного елемента має електронну формулу, наведену на малюнку 77?
Другий енергетичний рівень може вмістити максимум 2 · 22 = 8 електронів. Два з них займають одну s-орбіталь, але більшого об’єму, ніж та, що належить першому рівню. Ці електрони мають різні спіни. Решта (шість) електронів другого рівня перебуває в р-орбіталях. Оскільки кожна орбіталь може містити не більше двох електронів, то кількість р-орбіталей — 6 : 2 = 3. Це орбіталі одного енергетичного
електронної формули, розмістивши позначення p-орбіталей вище, ніж s-орбіталі:
позначають так само, як і відповідні орбіталі: 2s-підрівень, 2p-підрівень (схема 4).
Третій енергетичний рівень


3s-підрівні, 3p-підрівні,
і складних речовин.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі,
щення в атомах. Сформулюйте цікаве

ставте
Перевірмо себе
1. Чим електрон відрізняється від фізичного тіла?
2. Яку частину атома називають орбіталлю? Охарактеризуйте форми s- і p-орбіталей та їх розміщення в атомі.
3. Узгодьте кожне позначення з його змістом: а) заповнена орбіталь; б) спарені електрони; в) неспарений електрон; г) порожня (вакантна) орбіталь; д) електрони з протилежними спінами.
4. Енергія якого електрона менша — розміщеного в p-орбіталі 2-го енергетичного
Порівняймо
5.
ІІ. Максимальна кількість електронів
рівні та підрівні є парною.
А. Правильне лише І.
Б. Правильне лише ІІ.
В. Обидва правильні.
Г. Немає правильних.
Поміркуймо
8. Який запис, на вашу думку, надає більше інформації про електрони, що містяться в атомі — електронна формула чи її графічний варіант? Чому?
9. Серед указаних
Будь-які моделі дають змогу уявити
передусім важкодоступні для спостереження, а також явища, які потребують пояснення. Розглядаючи електронну будову атомів хімічних елементів, ми використаємо модель атома, у якій електрони розподілені в атомі за своєю енергією. Ця
перебувати якомога
формула атома Гідрогену1 та її графічний варіант: 1Н 1s1; 1s .
Атом елемента № 2 Гелію містить два електрони. Чи може другий електрон надійти на перший енергетичний рівень? Так, бо максимальна ємність першого рівня — 2 електрони.
атомі елемента № 3 Літію — 3 електрони. Два електрони займають 1s-орбіталь (заповнюється перший енергетичний рівень), а третій електрон надходить на другий рівень (схема 4, с. 148). Із 2s- і 2р-орбіталей він «обирає» ту, у якій матиме нижчу енергію, тобто 2s-орбіталь. Електронна формула атома Літію
3Li 1s22s1;
Електрони на останньому енергетичному рівні атома називають
нішніми. В атомі
2s-орбіталі.
Щоб виокремити в атомі зовнішні електрони, використовують скорочений запис
[He]2s1. Символ
у квадратних дужках означає, що внутрішня електронна оболонка атома
6,941
4Be 1s22s2, або [He]2s2
5B 1s22s22p1, або [He]2s22p1;
В атомі елемента № 6 Карбону з’являється шостий електрон. Він може розміститися разом із
електроном у р-орбіталі або зайняти вільну р-орбіталь. Реалізується друга можливість: електрони, маючи однойменні заряди, відштовхуються
їм вигідніше перебувати в різних орбіталях.
Електронна формула атома Карбону
6C 1s22s22p2, або [He]2s22p2;

вільну орбіталь підрівня, а в разі її відсутності «підселяється» в орбіталь до іншого електрона, складіть електронні формули атомів Нітрогену, Оксигену, Флуору та Неону, а також зобразіть графічні варіанти цих формул.
Моделі атомів хімічних елементів 2-го періоду з орбіталями другого енергетичного рівня зображено на малюнку 79 (напівзаповнені орбіталі — світло-сірі, цілком заповнені — темно-сірі).
Мал. 79. Моделі атомів елементів 2-го періоду Li Be B C N O F Ne

11Nа 1s22s22p63s1 ,
[Ne]3s1;


1.
ють електрони, збігається з номером
титься хімічний елемент.
2. Кількість зовнішніх електронів в
у
19K 1s22s22p63s23p64s1 ,

[Ar]4s1; 1
тів 4-го періоду, візьміть до уваги, що енергія електронів на підрівнях зростає в такому порядку (схема 4, с. 148): 4s → 3d → 4p.
тронами дещо порушується: один електрон переходить із 4s-орбіталі в 3d-орбіталь (форзац 1).
Електронна будова атомів і класифікація хімічних елементів. Залежно від типу орбіталі, у якій перебувають електрони з найбільшою енергією, розрізняють s-елементи, p-елементи, d-елементи і f-елементи1. s-Елементи (крім Гелію) перебувають у головних підгрупах І та ІІ груп короткого варіанта періодичної таблиці, а р-елементи — у головних підгрупах ІІІ—VIII груп.

До s- чи p-елементів належать Сульфур, Барій, Калій, Неон, Йод?
В усіх побічних підгрупах містяться d-елементи. Лантаноїди та актиноїди, які належать до ІІІ групи, є f-елементами; їх винесено за межі основного поля періодичної таблиці.
За кількістю електронів на зовнішньому енергетичному рівні атома можна визначити характер хімічного елемента. Атоми металічних елементів мають зазвичай 1—3 таких електрони, атоми неметалічних елементів

від 4-х до 8-ми електронів. Назвіть неметалічні елементи 1—2-го періодів, які є винятками. Наводимо

1. Назвіть
а) 1s22s22p63s23p2; б) [Нe]2s22p5; в) [Ar]4s2 .
2. Атом на другому енергетичному
4.
7.*
Дізнаєтеся, зрозумієте, використаєте
Атом — найдрібніша частинка багатьох речовин. Науковці ототожнюють атоми з мікроскопічними сферами. Величину сфери визначають за її радіусом. Від радіусів атомів залежить розміщення цих частинок у молекулі, форма кристалів речовини, її властивості.
Розмір атома зумовлюють найбільші за об’ємом і найдовші орбіталі, у яких перебувають електрони (мал. 79). Радіус атома — відстань від центра
верхні, якої «торкаються»
кількість енергетичних рівнів з електронами. Заряди ядер атомів у періоді збільшуються. Що більший заряд ядра, то ближче до нього перебувають електрони і радіус атома менший. Таку залежність пояснює закон фізики, згідно з яким частинка з більшим зарядом сильніше притягує протилежно заряджену частинку.
Радіуси атомів хімічних елементів у
зменшуються зі збільшенням заряду
ядер.
ріоді ілюструє малюнок 80.

Мал. 80.

Порівняйте радіуси атомів металічних елементів і атомів неметалічних елементів 3-го періоду та зробіть висновок.
Якщо порівняємо розміри атомів хімічних елементів у головній підгрупі періодичної таблиці, то виявимо таку залежність: що більше енергетичних рівнів з електронами має
радіус (мал. 81).
Na Mg Al Si P S Cl Ar Мал. 81.

(ніби нейтралізуються) негативними зарядами «внутрішніх» електронів, кількість яких
Унаслідок цього розміри атомів елементів однієї підгрупи визначаються тим, якою є кількість енергетичних рівнів, на яких перебувають електрони.

Розмістіть символи хімічних елементів N, P і F за збільшенням радіусів атомів.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про радіус атома та
радіусів атомів елементів у періодах і групах

2. Визначте
радіус: а) С — N; в) He — Ne; б) F — Br; г) H — He. Поясніть свій вибір.
якого
5.
в) радіус атома Кальцію більший, ніж атома Натрію. Формуймо словничок
7. Складіть двомовний словничок із
9. Виконайте
(https://learningapps.org/display?v=pi8wokkcn24) завдання за матеріалом параграфів 25—30. test

Навколо кожного з нас — багато речовин. Є речовини, у яких містяться атоми — однакові або різні. Чимало речовин утворені молекулами. Третій тип найменших частинок, з яких складаються речовини, — йони. На відміну від атомів і молекул це заряджені частинки; одні йони мають позитивний заряд, інші — негативний.
речовина
будови містить протилежно заряджені йони. Як і чому сполучаються в речовинах найменші частинки різних типів, ви дізнаєтеся з матеріалу, вміщеного в цьому розділі. З’ясуємо, як впливає будова речовин на їхні фізичні властивості, а також особливості будови твердих речовин у кристалічному стані.
З’єднаймо місточками мікросвіт атомів, молекул і йонів із макросвітом речовин.
Електрони утримуються в атомі, оскільки, маючи
заряд, притягуються до позитивно
сполучалися з атомами інших елементів. Причина хімічної пасивності цих речовин стала зрозумілою після з’ясування будови атомів.
Звернімо увагу на електронну будову атомів
s22s22p6; (зовнішні електрони) 3s 3p
Ar — 1s22s22p63s23p6; (зовнішні електрони)
Два електрони в
Гелію заповнюють перший енергетичний рівень. Електронна оболонка атома Неону складається вже з двох заповнених рівнів: перший містить 2 електрони, а другий — 8. В атомі Аргону, крім цих рівнів, є третій, незавершений; на ньому розміщуються 8 електронів, які заповнюють 3s- і 3р-підрівні.
Атоми Криптону, Ксенону і Радону також мають на останньому (незавершеному) енергетичному рівні по 8 електронів — два електрони в s-орбіталі та шість електронів у трьох p-орбіталях. Узявши до уваги хімічну пасивність інертних газів і електронну будову атомів інертних елементів,


Ковалентний зв’язок у молекулі водню зображають двома способами: Н:Н або Н–Н. Перший запис називають електронною формулою молекули; у ньому кожен електрон позначають крапкою. Другий запис — графічна формула молекули1. Відтепер ви знатимете, що рискою позначають спільну пару електронів двох атомів. Утворення молекули водню з атомів можна зобразити схемою Н· + ·Н Н:Н.
Молекула Н2 є достатньо стійкою; вона розпадається на атоми за температури, вищої за 2000 С.
Зв’язок у молекулах О2 і N2. Атоми Оксигену в молекулі кисню О2 й атоми Нітрогену в молекулі N2 сполучені ковалентним
кожний атом має 8 зовнішніх електронів (як і атом інертного елемента Неону). Повна електронна формула молекули кисню О::О : : : : , а графічна формула — О=О.



Складіть повну електронну формулу молекули азоту.
Графічна формула молекули азоту — NN. Ковалентний зв’язок, який реалізується за допомогою однієї спільної пари електронів, називають простим зв’язком. Якщо атоми мають дві спільні пари електронів, то зв’язок між ними подвійний, а якщо таких пар три — потрійний. Більшої кількості спільних пар електронів у двох сполучених атомів не буває. Простий зв’язок іноді називають одинарним зв’язком.

Ковалентним зв’язком сполучені атоми в молекулах інших неметалів — хлору Cl2, білого фосфору P4, сірки S8 тощо. Необхідною умовою для утворення зв’язку цього виду є наявність у кожного з атомів одного або кількох неспарених електронів.

Ковалентним зв’язком сполучаються між собою
важно неметалічних елементів.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про те, електронні оболонки якого складу забезпечують стійкість атомів і як сполучені атоми в молекулах

3. На малюнку 82 зображено модель молекули білого фосфору P4. З якою кількістю атомів сполучений кожний атом у цій молекулі? Простими, подвійними чи потрійними є ковалентні зв’язки між атомами в молекулі P4?
Виконаймо вправу
4. Складіть повну і спрощену електронні формули молекули F2 та зобразіть графічну формулу цієї молекули.
Поміркуймо
Мал. 82.
5. У молекулі кисню чи в молекулі азоту зв’язок між атомами,
те,
6.* Зобразіть графічну формулу
S8, якщо
7. Випишіть
яких — два неспарених. Атому Гідрогену потрібно отримати додатковий електрон, щоб у ньому був заповнений єдиний енергетичний рівень (1s2). Атому Оксигену треба мати 2 додаткових електрони, щоб другий енергетичний рівень у нього став заповненим (2s22p6). Отже, сполучення атомів Гідрогену та Оксигену, які мають неспарені електрони, цілком реальне.
Унаслідок зближення атомів відбуваються
перекривання 1s-орбіталей з електронами атомів Гідрогену і 2р-орбіталей з неспареними електронами атома Оксигену; утворюються дві спільні пари електронів (мал. 83).
Повна електронна формула молекули води: Н:О: Н : :


Простим, подвійним чи потрійним ковалентним зв’язком сполучені атоми в молекулі води?
У графічних формулах молекул іноді вказують додаткові
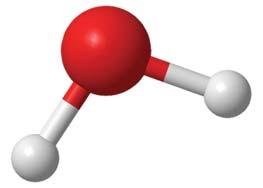
Мал. 84.
Скориставшись QR-кодом або покликанням (https:// h8.academiabook.club/rozdil-3-p-32.html), ви можете дізнатися про види моделей молекул, які використовують дослідники/дослідниці.
Будова молекули вуглекислого газу. У молекулі СО2 атом Карбону сполучений із двома атомами Оксигену.


Запишіть електронну формулу атома Карбону і зобразіть
Карбону, атомі Оксигену?
Атом Карбону перед утворенням

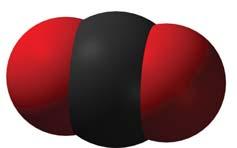

Мал.

Запишіть електронну формулу атома Сульфуру і зобразіть її графічний варіант.
В атомі Сульфуру, як і в атомі Оксигену, міститься два неспарених електрони. Для того щоб сполучитися з двома атомами Оксигену, йому потрібно мати 4 таких електрони. Атом Сульфур може збільшити кількість неспарених електронів,
енергетичному рівні є вільні 3d-орбіталі. Цей атом, як і
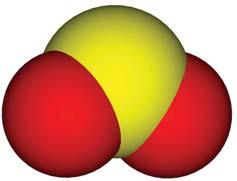

Мал. 86.

себе
1. Поясніть, як відбувається утворення молекули хлороводню HCl з атомів.
2. Чим різняться масштабна і кулестержнева моделі молекули?
3. Зобразіть графічну формулу молекули:
а) за її спрощеною електронною формулою О::N:Cl; б) за її хімічною формулою Cl2O.
Аналізуймо
4. Укажіть правильне закінчення речення «У молекулі HCN між атомами є …»:
а) один простий і один потрійний зв’язок;
б) два подвійних зв’язки;
в) один простий і один подвійний зв’язок;
г) два простих зв’язки.
5.* Запишіть повну електронну формулу молекули амоніаку NH3 і зобразіть графічну формулу цієї молекули. Поясніть, чому всі атоми молекули NH3 не розміщені на одній площині (мал. 87, а).
Шанс для творчості
6. На малюнку 87, б зображено масштабну модель молекули сірчаної кислоти H2SO4. Використавши її, складіть графічну формулу молекули кислоти. Опишіть електронну будову атома Сульфуру, яка зумовлює утворення цієї молекули.
7. З’ясуйте, у який колір
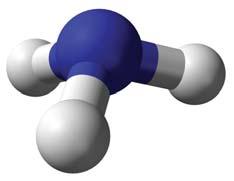
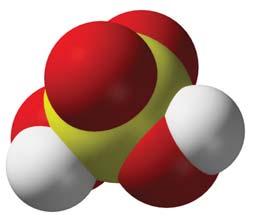

різного кольору. Стержень імітує риску в графічній формулі молекули. Пропонуємо вам виготовити кулестержневі
кількістю
Визначимо валентність Карбону у вуглекислому
бону сполучений
тому є чотиривалентним. Сподіваємося, ви здогадалися, що
повідає кількості спільних
атомами. Отже, прогнозувати валентність хімічного елемента
У § 32 йшлося про здатність атома Сульфуру змінювати електронну будову, що спричиняє зміну кількості неспарених електронів у ньому. Отже, валентність цього елемента змінна. Так, у сірководні H2S Сульфур двовалентний, а в сірчистому газі SO2 — чотиривалентний. Доведіть валентність Сульфуру

SO2, склавши спрощену електронну формулу молекули речовини
PV3, 5
SVI2, 4, 6
ClVII1, 3, 5, 7
Звертаємо


двох елементів за її хімічною формулою. Значення валентності елемента в речовині з’ясовують у тому разі,

Складання хімічних формул
за валентністю елементів. Виконаємо
разом
Cкладемо хімічну формулу сполуки
якій Сульфур шестивалентний. Запишемо символи елементів, якими утворена сполука, і вкажемо VI II над ними значення валентності елементів: S...O... . Обираємо найменше число, яке ділиться без залишку на обидва значення валентності, тобто найменше спільне кратне. Це число 6.
речовини: S6/6O6/2 => SO3.

атомами. Складіть хімічні формули сполук
із Флуором та Оксигеном.
Складаючи формули сполук, утворених
ку записують символи металічних елементів, а потім — неметалічних. Якщо сполука утворена лише неметалічними елементами і серед них є Оксиген або Флуор, то ці хімічні елементи записують останніми. У формулі сполуки

інших аналогічних сполук цього хімічного елемента застосовують

тронною формулами?
3.
4.
сполук:
IV I I IV III SCl4; PBr5; NI3; CS2; P3N5.
Виконаймо вправу
Визначте валентність елементів у сполуках, що мають такі формули:
а) V2O5, SiF4, PH3; б) H2Se, P2O3, Mn2O7.
5.* Складіть формули сполук: IV VI а) Si...H..., W...O...; O...F...; III V IV I б) N...O..., P...O..., C...Cl... .
6. Визначте валентність елементів у сполуках за графічними формулами молекул: H–N=C=S; O=Сl–О–Сl=O; H–O–Se–O–H. O = O =
Інформація про будову речовини та хімічний зв’язок, яким сполучені її найменші частинки, є дуже важливою. Від будови речовин залежить більшість їхніх фізичних властивостей, а також значною мірою і хімічні. На властивості речовин, які складаються з атомів, впливає й те, сполучені всі атоми чи відокремлені один від одного.
Дізнаєтеся, зрозумієте, використаєте Які фізичні властивості характерні для речовин молекулярної та атомної будови? Як передбачати фізичні властивості речовини за її будовою?
Речовини молекулярної будови. Речовин, які утворені молекулами, — більшість. Ви вже знаєте, що молекулярну будову з-поміж простих речовин мають кисень, азот, водень, сірка, а серед складних — вода, амоніак, вуглекислий і сірчистий гази. З молекул також складаються всі кислоти, зокрема оцтова, лимонна, сірчана, сполуки Карбону з Гідрогеном, вуглеводи, білки, жири тощо.
Хімічні формули деяких молекулярних речовин мають кратні індекси. Це стосується, наприклад, гідроген пероксиду: H H H2O2 O–O ––хімічна формула графічна формула Формулу Н2О2, яка показує реальний склад молекули речовини, називають істинною, а запис НО — найпростішою формулою. Трапляється, що одна найпростіша формула відповідає кільком речовинам з різними істинними формулами. Так, ацетилен С2Н2 (цей газ використовують у процесі зварювання металів) і бензен С6Н6 (рідину застосовують в органічному синтезі) мають
формулу — СН. Але істинні формули більшості молекулярних речовин
ператур. Для них характерні також
і низька твердість. Деякі речовини під час нагрівання змінюють свій агрегатний стан із твердого одразу на газуватий, минаючи рідкий.
явище
сублімацією1. Цю властивість мають, наприклад, йод I2, карбон(IV) оксид CO2 (мал. 88)2. Лід за температури,



но зі «звичайними»?
Чимало молекулярних речовин має запах. Вам добре відомий різкий запах сірчистого газу SO2. Ця речовина утворюється в момент запалювання сірника (сірка є у складі його голівки). Газ амоніак NH3 також легко впізнати за запахом. Він виділяється з водного розчину цієї сполуки, відомого під назвою

сполучені ковалентним зв’язком.
них — прості речовини бор, графіт, алмаз, силіцій, а також невелика кількість





Наведіть приклади використання речовин з високою твердістю.
Інертні гази також мають атомну будову, але атоми в них не сполучені між собою. Унаслідок цього температури плавлення і кипіння речовин дуже низькі. Наприклад, газ гелій перетворюється на рідину за температури –269 С, близької до «абсолютного нуля».
ВИОКРЕМЛЮЄМО ОСНОВНЕ Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про найпростішу та істинну формули речовини, фізичні властивості речовин молекулярної та атомної
. Сформулюйте цікаве запитання

2. У параграфі наведено хімічну формулу оцтової кислоти СН3СООН. Це — істинна формула речовини. Чи є вона найпростішою? Якщо ні, то запишіть найпростішу формулу цієї кислоти.
3. Сполука Х за стандартних умов перебуває у твердому стані, має запах, а за помірного нагрівання плавиться.
Поміркуймо
6. Чому сполуки CO2 і SiO2 істотно різняться фізичними властивостями, хоча в цих речовинах реалізується один і той самий вид хімічного зв’язку — ковалентний?
7. Карборунд SiC — сполука атомної будови. Спрогнозуйте фізичні властивості речовини та перевірте своє передбачення, відшукавши необхідну інформацію в інтернеті. У команді
8. Назвіть кілька речовин і сумішей, що мають запах і використовуються в кулінарії. З атомів чи молекул складаються ці речовини та відповідні компоненти сумішей?
9. У м. Брюссель (Бельгія) є монумент «Атоміум» (мал. 90), який було споруджено до відкриття Всесвітньої виставки у 1958 р. Спробуйте пояснити назву цього монумента. (Можливо, запропонуєте для нього іншу назву.)
Формуймо словничок

10. Випишіть ключові слова і словосполучення з тексту
укладання двомовного словничка.
Оцінюймо свої знання
11. Створіть у зошиті таблицю оцінювання ваших знань і заповніть її.
12. Виконайте розміщені

атомами?
Електронегативність хімічних елементів. Атоми різних елементів зазвичай виявляють
Властивість
пару електронів,
тронегативністю.
Що менший радіус атома і більший
притягує спільну пару електронів. Атом якого елемента є більш електронегативним — Оксигену чи Карбону?

Електронегативність хімічного елемента можна оцінити кількісно. Відповідні обчислення були здійснені за результатами фізичних досліджень атомів. Найчастіше використовують шкалу електронегативності американського науковця Лайнуса Полінга (табл. 6).
цією та іншими шкалами найбільш електронегативним елементом є Флуор, а найменш електронегативним — Цезій. Значення електронегативності металічних елементів менші, ніж неметалічних. Чому в таблиці



Хлору.
Атому кожного елемента вигідно отримати додатковий
атом Гідрогену заповнить свій єдиний
рівень, а атом Хлору матиме вісім електронів
(3s23p6). Унаслідок перекривання 1s-орбіталі атома Гідрогену і 3р-орбіталі атома

H :Cl.
(він дорівнює –0,2), а атом
ням, але позитивного (+0,2).
Для загального позначення
використовують грецьку літеру («дельта») разом зі знаком «+» або «–». Розглянуту особливість ковалентного зв’язку в молекулі хлороводню зображують
електронів
ним зв’язком
ним зв’язком.
Полярний ковалентний зв’язок реалізується в молекулах багатьох складних речовин — HF, NH3, SO3, SiCl4, BF3 та ін. Неполярним ковалентним зв’язком сполучені атоми в молекулах неметалів, у простих речовинах атомної будови — алмазі, графіті, силіції, а також атоми хімічних елементів з однаковою електронегативністю в молекулах складних речовин.

Скориставшись інформацією, наведеною в таблиці 6, укажіть формули молекул з полярним і неполярним ковалентним зв’язком: I2, СO2, SF4, PH3, Cl2O7.
Що більша різниця електронегативності хімічних елементів, то полярніший зв’язок між їхніми атомами.


1.
зв’язком.
3. Чому атоми, сполучені ковалентним зв’язком, можуть набувати невеликих зарядів?
4. Серед наведених формул укажіть ті, що відповідають речовинам з неполярним і полярним ковалентним зв’язком: H2S, SiO2, P4, CF4, NCl3. Поясніть ваш вибір.
Поміркуймо
5. Символи хімічних елементів часто розміщені у формулах сполук
збільшенням електронегативності елементів. Укажіть серед наведених формул такі, у яких немає зазначеної послідовності: Na2CO3, NH3, SiO2, H2S, NaOH, CH4, HNO3. Аналізуймо
лах молекул OF2, СH4 і SiCl4. Який зв’язок у цих молекулах найбільш полярний, а який — найменш полярний?
7.* Укажіть правильне закінчення
становлять відповідно …»:
а) 0,8 і 1,0; б) 1,0 і 0,8; в) 1,0 і 1,2; г) 0,8 і 0,6.
пати за температури,
в матеріалі параграфа. Дізнаєтеся про вид хімічного зв’язку, який називають водневим, і його вплив на властивості речовин.
Дізнаєтеся, зрозумієте, використаєте
Чому молекули певних речовин є полярними?
Який вид хімічного зв’язку називають водневим зв’язком?
Полярність молекул. Ви вже знаєте, що атоми, які різняться електронегативністю,
лекулах галогеноводнів
спільна

Оксигену –0,34.
полярних
між атомами
завжди спричиняє її полярність. Молекула вуглекислого газу є лінійною: О=С=О (§ 32). Подвійні зв’язки між атомами Оксигену і Карбону полярні; спільні пари електронів зміщені в бік більш електронегативних атомів Оксигену. Ці атоми мають
удвічі більший позитивний заряд. Оскільки молекула СО2 в центрі заряджена позитивно, а по
вона неполярна і не є диполем.
Полярність молекул істотно впливає на властивості речовин.
Водневий зв’язок. Молекули-диполі води, амоніаку та багатьох інших речовин можуть притягуватися одна до одної своїми протилежно зарядженими частинами.
Електростатичну
атомів Гідрогену і найбільш електронегативних
Водневий
позначатимемо трьома крапками: Н···О. Він значно слабший за ковалентний зв’язок. Обов’язкова умова його утворення — наявність у молекулі речовини атома Гідрогену, сполученого з атомом Оксигену, Флуору або Нітрогену.
Водневі зв’язки є у воді (мал. 92, б), етиловому спирті, кислотах, білках; вони також утворюються між молекулами цих речовин і води в розчинах. Щомиті частина водневих зв’язків у рідких речовинах і розчинах руйнується, але водночас утворюються нові такі самі зв’язки. У твердих

Мал.
(мал. 92, б). Унаслідок
ніж, наприклад, рідкий
уважимо,



рівняйте
Спробуйте пояснити, чому між молекулами метану не утворюються водневі зв’язки,
полярним. Скористайтеся моделлю молекули СН4. У таблиці наведено температури

Перевірмо себе
1. Поясніть, чому молекула води є полярною.
2. Прокоментуйте утворення водневого
3. Іноді кажуть, що водневий зв’язок коректніше називати гідрогеновим зв’язком. На чому ґрунтується ця думка?
Поміркуймо
4.* Молекула амоніаку NH3 має форму трикутної піраміди (с. 170, мал. 87, а). Зобразіть поряд графічні формули двох молекул амоніаку та позначте водневий зв’язок між цими частинками. Чому цей зв’язок є в рідкій і твердій
речовин Крім атомів і молекул, існує ще один тип частинок, з яких складаються речовини, — йони. Вони містяться в природній воді, ними утворена більшість мінералів. Слово «йон» є частиною інших слів. Верхній шар атмосфери, у якому, крім молекул і атомів газів, містяться йони (а ще й електрони), називають йоносферою. Йонообмінні смоли використовують для одержання чистої води, а літій-йонні акумулятори є поширеними хімічними джерелами струму.
Дізнаєтеся, зрозумієте, використаєте
Чим йони відрізняються від атомів? Як записати формулу йона? Як визначають електронну будову йонів? Йони. Атоми багатьох

Запишіть електронні формули частинок, що утворюються, і визначте їхні електричні заряди.
Заряджені частинки обох типів у речовині LiF та багатьох інших речовинах називають йонами.
Йон — заряджена частинка, яка утворюється з атома внаслідок втрати
тронів.
Якщо атом втрачає один електрон, то перетворюється на йон із зарядом +1, а в разі приєднання ним, наприклад, двох електронів — на йон із зарядом –2. Позитивно заряджені йони називають катіонами, негативно заряджені — аніонами. Чим зумовлений позитивний заряд катіона?

Катіони H+, Ba2+
Аніони Cl–, O2–
У хімічній формулі йона заряд позначають верхнім індексом праворуч від символу елемента; спочатку записують цифру (одиницю не вказують), а потім — знак заряду: Li+, Ba2+, Н+, F–, S2–. Хімічну формулу першого йона читають «літій-плюс», останнього — «ес-два-мінус». Ці частинки називатимемо так: йон (або катіон) Літію, йон (або аніон) Сульфуру. Є також йони, утворені кількома атомами (мал. 94). Наприклад, у складі речовини NaOH містяться, крім катіонів Na+, аніони ОН–, а в аміачній селітрі (добриво) — катіони NH4+ й аніони NO3 – . Атоми в таких йонах сполучені ковалентним зв’язком.
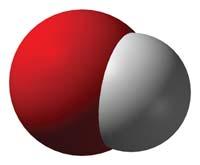
Мал. 94.
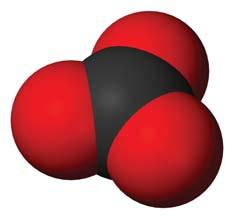
Моделі складних йонів OH– NH4 + CO32–
добрива. Утворення позитивно заряджених йонів. Елемент № 11 Натрій розміщений у періодичній таблиці після інертного елемента Неону. Ядро атома Натрію містить 11 протонів (заряд ядра становить +11); навколо нього перебуває стільки ж електронів. Серед них один електрон належить зовнішньому (третьому) енергетичному рівню, а вісім — передостанньому рівню (2s22p6).
Під час хімічної реакції за участю металу натрію атом Натрію легко втрачає електрон, який перебував у 3s-орбіталі, і перетворюється на йон. Заряд цієї частинки визначаємо так: +11 (заряд ядра) – 10 (сумарний заряд електронів) = +1. Оскільки ядро залишається незмінним, то
йон, як і атом, належить елементу Натрію.
Електронна будова катіона Na+ така сама, що й атома Неону (обидві частинки містять по 10 електронів). Цей йон є стійким, оскільки має зовнішній електронний октет.
Схема перетворення атома Натрію на йон та електронні формули частинок:
Na – e – Na+; атом Na — 1s22s22p63s1, або [Ne]3s1; йон Na+ — 1s22s22p6, або [Ne].
Електронний октет міг би утворитися внаслідок


частинок такі:
Cl + e – Cl–;
атом Cl — 1s22s22p63s23p5, або [Ne]3s23p5; йон Cl– — 1s22s22p63s23p6, або [Ar].
Аніони Cl– містяться в більшості сполук металічних елементів із Хлором, зокрема в натрій хлориді NaCl.



Напишіть схему перетворення атома Оксигену на відповідний йон і наведіть електронні формули обох частинок.
1. Атоми неметалічних елементів (окрім інертних) мають на зовнішньому енергетичному рівні від чотирьох до семи електронів і здатні приєднувати додаткові електрони, перетворюючись на аніони.
2. Йони елементів головних підгруп
радіус трохи більший.
Обидва види частинок мають різні властивості. Атоми, з яких складається метал натрій,
Атоми Хлору
Cl–
Маси атома і відповідного катіона (аніона) різняться незначною мірою. Тому в обчисленнях, які стосуються йонів, використовують відносні атомні маси
Аr(Li) Аr(Li+); Аr(F) Аr(F–)
або молярні маси: М(ОН–) 17 г/моль; М(NH4+) 18 г/моль.
Вміст йонів за масою в питній і мінеральній воді зазначають на етикетках пляшок (мал. 95).

ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у
у зошиті висновки про перетворення

2. Укажіть, який з елементів — Кальцій чи Нітроген — може утворювати
6. Укажіть у поданому переліку частинку з найбільшим радіусом і найменшим радіусом: атом Ne, йони Na+, Mg2+, F–. Відповідь обґрунтуйте. Виконаймо вправу
7. Напишіть хімічні формули частинок, у яких електронна будова зовнішнього енергетичного рівня — 3s23p6 .
8. Складіть електронну формулу частинки, яка має 8 протонів і 10 електронів. Назвіть цю частинку.
9. Допишіть у схеми утворення йонів знаки «плюс» або «мінус» і відповідну кількість електронів: а) I … e – I–; б) Al … e – Al3+.
10. Напишіть схеми утворення катіона та аніона Гідрогену з атома. Яка частинка має найменший радіус — катіон, аніон чи атом Гідрогену? Чому?
У команді
11.* Назвіть три
що і йона F–.
12. Слово «йон» походить від грецького «іон» (той,
свої заряди. Електростатичну взаємодію
протилежно зарядженими йонами в речовині називають йонним зв’язком. До речовин йонної будови належить більшість оксидів металічних елементів, сполуки лужних елементів із галогенами, Сульфуром тощо. Ці речовини містять катіони металічних елементів (наприклад, Na+, Ca2+, Al3+). Аніонами в йонних оксидах є йони О2–, в інших сполуках металічних елементів — Cl–, S2–, NO3–, СO32–, PO43– та ін.


Сполуки двох неметалічних елементів, наприклад хлороводень HCl, вуглекислий газ СО2, йонів не містять.
У харчовій соді NaHCO3 містяться катіони Na+. Запишіть формулу аніонів, які є в цій речовині.
Для того щоб скласти формулу йонної сполуки, необхідно знати, якими катіоном та аніоном вона утворена, а також заряди цих частинок. Оскільки кожна речовина є електронейтральною, то в йонній сполуці


1. У мінералі фенакіті містяться йони Be2+ і SiO4 4 –. Складіть формулу мінералу.
2. Мінерал апатит містить йони Ca2+, PO43– і F–. Катіонів Ca2+ у речовині в п’ять разів більше, ніж аніонів F–. Складіть формулу мінералу.
Графічні формули йонних сполук не використовують, оскільки рисками з’єднують символи хімічних елементів, атоми яких сполучені ковалентним зв’язком.
Фізичні властивості йонних сполук. Усі сполуки, які складаються з йонів, за стандартних умов є твердими, зазвичай кристалічними речовинами (мал. 96). Оскільки йони сполучаються один з одним досить міцно, то руйнування йонного зв’язку потребує витрати чималої енергії. Тому більшість йонних речовин має високі температури плавлення і кипіння. Під час плавлення кристали руйнуються, зв’язки між йонами послаблюються, а під час кипіння розплавленої речовини йони відокремлюються один від одного і
NaCl плавиться за температури 801



Відомо, що
тричний струм — це
частинок (електронів, йонів). У кристалі речовини йони займають фіксовані позиції і переміщуватися не можуть, а в її розплаві ці частинки рухаються в довільних напрямках. У разі занурення в розплав електродів, з’єднаних із джерелом постійного струму (акумулятором), катіони починають рухатися до негативно зарядженого електрода, аніони — до позитивно зарядженого. Так у розплавленій йонній речовині виникає електричний струм. Викладені в цьому і попередніх
ного зв’язку підсумовує схема 5. Схема 5 Види хімічного
Молекулярні речовини
Br2, H2O, СН4
Речовини атомної будови C, SiO2
Йонні речовини Li2O, KCl, NaOH ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про йонний зв’язок, речовини йонної
та їхні властивості.
Сформулюйте

3. Напишіть формули йонів, з яких складаються такі речовини: ZnO, Cr2O3, CaS, Li3N, BaH2.
4. Складіть формули сполук, утворених такими йонами:
а) Ag+ і O2–; г) Na+ і PO43–; б) Sr2+ і ОН–; д) NH4+ і SO42–. в) Al3+ і S2–;
Аналізуймо
5. Яка зі сполук, на вашу думку, має вищу температуру плавлення:
а) Li2O чи Na2O; б) CaO чи CaF2?
Відповіді
тернеті.
Пояснюймо
6. Чому йонні речовини не мають запаху?
У команді
7.* Чи можна назвати пару сполучених йонів (наприклад, Na+ і Cl–) молекулою? Відповідь аргументуйте.
Розв'язуймо задачу
8. Обчисліть масові частки йонів
Формуймо словничок 9. Випишіть

Розгляньте кожну речовину. Який колір і характер її часточок?
Визначте, чи розчиняються речовини у воді.
Дослідіть поведінку речовин під час нагрівання. Яку речовину вам удалося розплавити?
Занотуйте в таблиці назву та фізичні властивості кожної речовини — колір, характер часточок, розчинність у воді, здатність до плавлення за помірного нагрівання:
Властивість речовини Речовини
МІРКУЄМО, ПОРІВНЮЄМО, АНАЛІЗУЄМО
Довідайтеся з інтернету про хімічні формули цукру і сечовини, а також про будову і температури плавлення цих речовин.
§ 39. Кристалічні речовини
Ви, напевно, бачили на фотографіях чудові кристали рубіну, сапфіру, аметисту, які «подарувала» нам природа. Багаті колекції мінералів зібрано в численних геологічних музеях. Мінерали — кристалічні речовини. Вони утворилися в надрах планети. Кристали різних речовин можна одержати в лабораторії, зокрема «виростити» з водних розчинів.

Мал. 97.
Кристали мінералів

вони не подібні на кристали. Ці речовини називають аморфними1. Вони, наприклад, є складниками крохмалю і борошна. За стандартних умов або низьких температур у кристалічному стані перебуває більшість простих і складних неорганічних речовин, а серед органічних речовин
речовини можуть перебувати як у кристалічному, так і в аморфному стані. Серед них — оксид SiO2. Він утворює мінерал кварц, який є кристалічною речовиною. Якщо охолодити розплав цього оксиду, одержимо аморфну речовину — скло (кварцове). З такого скла виготовляють вогнетривкий лабораторний посуд.
Кристали та їхня будова. Якщо розглянути кухонну сіль крізь збільшувальне скло, то можна побачити кристали-кубики (мал. 98). Інші форми мають кристалики цукру та лимонної кислоти.
Кристал — самоутворене фізичне тіло із пласкими гранями та прямими ребрами. Якщо його розбити, то на уламках помітимо ознаки форми кристала (наприклад, пласкі поверхні). Кристалічний стан речовини зберігається навіть після її ретельного подрібнення.
Предмет, який подібний

Форма кристала зумовлена впорядкованим розміщенням у твердій речовині атомів, молекул або йонів. Внутрішню будову кристалів описують за допомогою моделі, назва якої — кристалічні ґратки. Це схема або тривимірний макет розміщення частинок у маленькому об’ємі кристала (мал. 99).
Мал. 99. Кристалічні ґратки кухонної солі: а — кулестержнева модель; б — масштабна модель. Жовті кульки — катіони Na+, зелені — аніони Cl–
Кульки в кристалічних ґратках імітують йони, атоми, молекули. Ці частинки перебувають у так званих
лестержневих моделях (мал. 99, а)
торкаються одна одної. Використовують ще й масштабні моделі (мал. 99, б). У них радіуси кульок пропорційні радіусам частинок, і найближчі кульки контактують одна з одною (атоми, молекули, йони зазвичай щільно «упаковані» в кристалі). Кулестержнева модель є наочнішою, бо кульки в ній не заважають «зазирнути» всередину кристала. Розглядаючи кристалічні ґратки речовин атомної будови — алмазу і графіту (мал. 100), помічаємо, що в алмазі всі атоми сполучені однаковими міцними ковалентними зв’язками, а у графіті містяться шари атомів Карбону, які слабко сполучені між собою. Тому алмаз має найвищу твердість серед

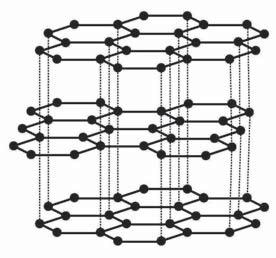

Cкільки атомів найближче розташовані до кожного атома
алмазі та графіті?
Кварц SiO2 також має атомну будову. Ковалентні зв’язки між атомами Силіцію та Оксигену є однаковими й міцними (мал. 101). Кварц — досить тверда речовина, яка залишає подряпини на склі та більшості металів.

Який ковалентний зв’язок — простий чи подвійний — імітує кожний стержень у кулестержневій моделі кварцу?
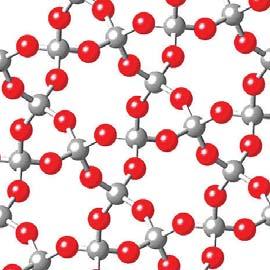
Будову йоду І2, льоду і твердого карбон(IV) оксиду («сухого льоду») СО2, які складаються з молекул, ілюструє малюнок 102. Слабка міжмолекулярна взаємодія в речовинах (наприклад, водневі зв’язки у льоді) зумовлює низькі температури зміни агрегатних
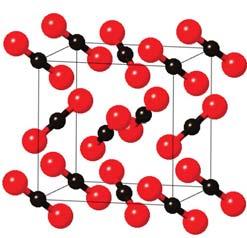
речовини, тобто відношення кількості катіонів та аніонів у речовині, а також від відношення радіусів цих частинок.
Якщо в кристалічних ґратках йонної сполуки виокремити найменший фрагмент, який повторюється, то він відповідатиме її хімічній формулі (мал. 103).
Фізичні властивості кристалічних речовин. Твердість, оптичні властивості багатьох кристалічних речовин залежать від того, у якому напрямку діє на кристал зовнішня сила або звідки потрапляє на нього промінь світла. Здатність кристалів деяких речовин перетворювати енергію одного виду на іншу зумовлює їх використання в системах запису інформації, приладах нічного бачення, гідрофонах, оптиці, медицині (наприклад, безконтактне вимірювання температури), побутовій техніці (п’єзозапальнички, навушники та ін.). Вагомі здобутки в галузі одержання та дослідження кристалічних речовин з особливими фізичними властивостями мають фахівці Науково-технологічного комплексу «Інститут монокристалів» НАН України (м. Харків).

ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про кристалічний та аморфний стани твердих речовин і моделі кристалів (кристалічні ґратки) речовин атомної, молекулярної та йонної будови.

Сформулюйте цікаве
Поміркуймо
4.* За зображенням кристалічних ґраток натрій хлориду (мал. 99) визначте: а) скільки йонів Cl– оточує кожний йон Na+ у кристалі солі; б) скільки йонів Na+ оточує кожний йон Cl–.
5. Напишіть формули йонів, які містяться у вузлах кристалічних ґраток мінералів флюориту CaF2 і корунду Al2O3.
Аналізуймо
6. У старому підручнику є такий підпис до малюнка: «Модель кристалічної ґратки вуглекислого газу». У чому
Дізнаваймося
7. Функціонування різноманітних дисплеїв, моніторів, електронних індикаторів забезпечують речовини, які називають рідкими кристалами. Відшукайте в інтернеті відомості про ці речовини і з'ясуйте, чому вони отримали таку назву. Шанс для
музею. Підготуйте стислий
проєкт
9. Підготуйте за матеріалами з інтернету повідомлення на тему «Шкала твердості мінералів (історія створення, використання)».
Формуймо словничок
10. Випишіть ключові слова і словосполучення з тексту параграфа для укладання двомовного словничка.
11. Складіть двомовний словничок із ключових слів і словосполучень, виписаних вами з параграфів 31— 39. Отримаєте словничок до розділу 3 підручника. Оцінюймо свої знання
12. Створіть у зошиті таблицю оцінювання ваших знань і заповніть її.
13. Скориставшись
learningapps.org/display?v=px6b7h9j325)
(https://learningapps.org/display?v=pofxg6gv524)


Важко уявити наше життя без таких речовин, як метали. Якби їх не було, ми б мешкали в дерев’яних хатинках, нікуди б не їздили, готували б їжу на вогнищі, використовували знаряддя праці з каменю, кісток тварин.
Металів налічується значно більше, ніж неметалів. Вони мають важливе значення в розвитку цивілізації. Метали, а також металеві сплави широко використовують у різних галузях промисловості, сільському господарстві, будівництві, транспорті, теплоенергетиці, техніці, військовій справі тощо. § 40. Метали. Металічний зв’язок
Широке застосування металів зумовлене наявністю в них властивостей, важливих для практики. Будову металів уже досліджено. Тому ми можемо пояснити, чому вони проводять електричний струм, мають металічний блиск,
мідна доба, бронзова доба, залізна доба. До нової ери людям були
відомі лише кілька металів — золото, срібло, мідь, ртуть, свинець, залізо, олово.
Деякі метали траплялися в природі (мал. 105). Інші метали люди навчилися одержувати з природної сировини — металічних руд.

Мал. 105. Самородні метали


Мал. 104.
Скіфський золотий гребінь (кінець V — початок IV ст. до н. е., Запоріжжя)

Метали є простими речовинами металічних елементів. До металічних елементів належать s-елементи (крім Гідрогену і Гелію), частина р-елементів, усі d- і f-елементи:

1. Укажіть 5 металів, назви
повідних металічних елементів.
2. У якому реченні з-поміж наведених ідеться
якому — про хімічний елемент? І. Цинк є компонентом мікродобрив. ІІ. Цинк плавиться за температури 419,5 С.
Оскільки в атомах металічних елементів на зовнішньому енергетичному рівні перебуває невелика кількість електронів (зазвичай від одного до трьох), то атоми можуть втрачати ці електрони й перетворюватися на позитивно заряджені йони (катіони): M – ne –= Mn+ .

Металічний зв’язок. Розглянемо, як відбувається процес утворення металу з багатьох атомів. Атоми зближуються один з одним, а потім сполучаються так, що їхні зовнішні орбіталі перекриваються. Електрони, що перебували в них, відокремлюються від «своїх» атомів, які перетворюються на катіони, і починають хаотично рухатися в металі від одного катіона до іншого (мал. 106). Ці електрони називають усуспільненими, або делокалізованими1 . Катіон, на мить отримавши один чи кілька електронів, перетворюється на атом, а за частку секунди відбувається зворотне перетворення. Незважаючи на появу катіонів і вільних електронів, метал навіть у дуже малому об’ємі залишається
тральним.
Будова металів. Метали зазвичай є кристалічними речовинами. Кристали металів значно дрібніші за ті, з яких складається, наприклад, сіль чи цукор. Докладніше про будову металів ви можете дізнатися з текстового фрагмента, розміщеного за покликанням у QR-коді (https:// h8.academiabook.club/rozdil-4-p-40.html).
ВИОКРЕМЛЮЄМО ОСНОВНЕ

text
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про метали, металічний
талів. Сформулюйте цікаве

1.
2. Запишіть формули йонів
які
утворюватися у відповідних металах.
3. Чому в металі не може реалізовуватися: а) йонний зв’язок; б) ковалентний зв’язок?
Дізнаваймося
4. Назва якої країни Латинської Америки
міцні. Висока електропровідність
вилучати його із суміші
перероблення.
Дізнаєтеся, зрозумієте, використаєте Які фізичні властивості
для металів?
Які метали істотно відрізняються від інших за фізичними властивостями?
Метали мають характерні фізичні властивості, зумовлені наявністю в них металічного зв’язку.
Металічний блиск. Метал найчастіше впізнають за особливим, металічним блиском. Він є наслідком відбиття вільними електронами світлових променів, спрямованих на поверхню металу. Деякі метали за стандартних умов реагують із киснем повітря, водяною парою, і їхня поверхня вкривається шаром різних сполук. Через це натрій, кальцій, свинець мають блиск лише на «свіжому» зрізі.


Електропровідність. Усі метали проводять електричний струм. Він виникає в металі після з’єднання його з акумулятором; у цей момент рух вільних електронів стає спрямованим. Найвищу електропровідність має срібло, йому трохи поступається мідь (мал. 108), третє місце посідає золото, а четверте — алюміній. Теплопровідність. Метали значно краще проводять теплоту, ніж інші тверді речовини. Їхня висока теплопровідність зумовлена коливаннями катіонів у кристалах, а також рухом вільних електронів. Найкраще проводять теплоту метали з найбільшою електропровідністю — срібло, мідь, золото та алюміній.
Ковкість і пластичність. Більшість металів є пластичними. Їх можна кувати, витягувати з них дріт. Зігнувши мідну чи алюмінієву дротину, ви не зламаєте її. Під час деформації металу або його механічного оброблення шари катіонів зміщуються. Проте металічний зв’язок не руйнується (мал. 109), оскільки його забезпечують усуспільнені електрони — своєрідне «мастило» між катіонами. Найпластичнішим металом є золото; з нього можна виготовити надтонку й напівпрозору фольгу.

За матеріалами з інтернету дізнайтеся, які метали є крихкими.
Інші властивості. Температури плавлення багатьох металів перевищують 1000 С. Метали, які плавляться за значно нижчих температур, називають легкоплавкими. Серед них — свинець, олово, цинк, алюміній. Найтугоплавкішим металом є вольфрам (т. пл. 3422 С), а найнижчу температуру плавлення має ртуть (–38,8 С). Метал галій, температура плавлення якого +29,8 С, можна розплавити на долоні (мал. 110).
Густина металів змінюється в широкому інтервалі — від 0,534 (літій) до 22,6 г/см3 (осмій).

Мал. 108.
Високовольтний мідний кабель

Мал. 109.
Будова металу після пластичної деформації

Мал. 110.
Плавимо галій

тернеті
за воду?
Метали різняться також за твердістю. Найтвердішим є хром; ним можна різати скло. Найм’якіші метали — натрій, калій, свинець; їх можна різати ножем.
червона.
металів
Залізо, кобальт і нікель є феромагнетиками
здатні намагнічуватися
кий стан.
ВИОКРЕМЛЮЄМО
Проаналізувавши матеріал, викладений

Поміркуймо
6. Серед металів, які найчастіше використовують, мідь найкраще проводить електричний струм. Але раніше в електромережах житлових будинків часто застосовували алюмінієвий дріт. Як ви думаєте, чому? Яка, на ваш погляд, причина того, що згодом спеціалісти почали відмовлятися від використання алюмінію в електричних дротах?
Шанс для творчості
7. За матеріалами з інтернету підготуйте повідомлення про метал з особливими властивостями та його застосування.
8. Складіть інструкцію для виконання експерименту з визначення густини металу. В експерименті, крім зразка металу, необхідно використати електронні ваги, мензурку з поділками
9. Випишіть ключові

ДОСЛІДЖУЄМО ФІЗИЧНІ ВЛАСТИВОСТІ МЕТАЛІВ
Вам видано метали — мідь, залізо, цинк, олово, свинець (стружки, гранули), а також залізний цвях, ложечки для спалювання, пінцет, спиртівку чи сухе пальне, керамічну підставку, сірники.
Здійсніть запропоновані досліди (будьте обережними з вогнем). Спостереження, відповіді
шіть у зошит.
Дослід 3. Помістіть один метал у ложечку для спалювання. Запаліть спиртівку чи сухе пальне. Внесіть ложечку з металом у верхню частину полум’я.
Якщо за кілька хвилин метал розплавився, обережно вилийте розплав на керамічну підставку для охолодження, а якщо ні — вийміть його пінцетом із ложечки і покладіть на підставку.
Виконайте аналогічні дії з іншими металами.
Які метали вдалося розплавити?
§ 42. Метали як реагенти.
Окисно-відновні реакції
У хімічному кабінеті/лабораторії кислоти та їх розчини містяться у скляних ємностях. А чому не в металевих? Адже скляна пляшка може розбитися і кислота або її розчин
її. Почуєте від учителя/учительки
Дізнаєтеся, зрозумієте, використаєте
Як можна визначити хімічну активність металу?
Які зміни відбуваються з речовинами під час окисно-відновних реакцій?
Хімічні властивості металів. Багато металів є хімічно активними. Вони реагують з неметалами, складними речовинами. У будь-якій реакції за участю металу його атоми перетворюються на катіони: M – ne – Mn+ . Про реакції кількох

(мал. 111, 112). Спостерігати, як
рій і калій з водою, ви можете за покликанням у QR-коді (https://h8.academiabook.club/p-42-video.html). video

Мал. 111.
Кілька


Мал. 112.
дослідник М. Бекетов у 1865 р. Що лівіше в цьому ряді перебуває метал, то більшу хімічну активність він виявляє.

Микола Бекетов (1827—1911)
Вітчизняний хімік. Дослідив реакції солей у водних розчинах з металами. Запропонував ряд активності металів (1865). Розробив та описав один із методів одержання металів — металотермію. Сприяв становленню фізичної хімії — однієї з хімічних наук. Працював професором у Харківському університеті (1855—1887), уперше
науки.
Метали, які перебувають у ряду активності праворуч від водню, не взаємодіють із цими кислотами, а ті, що перебувають ліворуч, — реагують.

Зверніть увагу на розміщення в ряду активності калію і натрію (метали, утворені хімічними елементами І групи), а також барію, кальцію і магнію (метали, утворені хімічними елементами ІІ групи). Зробіть висновок щодо зміни хімічної активності металів залежно від розміщення відповідних хімічних елементів у кожній групі періодичної таблиці.
Результат досліду, у якому мідь взаємодіє
зі сполукою Аргентуму, розчиненою у воді, подано на малюнку 113. У цій реакції більш
активний метал (мідь) є реагентом, а менш активний (срібло) — продуктом: Cu + 2AgNO3 = 2Ag + Cu(NO3)2.
Окисно-відновні реакції. Якщо метал кальцій нагріти в повітрі до 300 С, то він загориться. Рівняння цієї реакції: 2Ca + O2 = 2СаО.
Кальцій оксид CaO складається з йонів Ca2+ і O2–. Отже, під час реакції
Кальцію втрачає два
ється на катіон: Са – 2е – = Ca2+.
і

Мал. 113. Реакція міді з речовиною AgNO3 в розчині
називають окисно-відновною реакцією.

Літій реагує із сіркою згідно з рівнянням 2Li + S = Li2S. Запишіть схеми окиснення і відновлення до цієї реакції. Яка речовина окиснюється, а яка відновлюється?
Речовину, що окиснюється, називають відновником, а речовину, яка відновлюється, — окисником. Атоми металу в хімічній реакції віддають електрони атомам або йонам другого реагенту. Метал завжди виконує функцію відновника;
окиснюється.
терміни, скористайтеся таблицею 7. Таблиця 7 Характеристика реагентів
РеагентиФункція реагентуНазва процесу перетворення реагенту
Речовина, яка
втрачає електрони ВідновникОкиснення
Речовина, яка
отримує електрони


ОкисникВідновлення
вуглекислого газу. Кисень — окисник, він відновлюється, а чадний газ — відновник, він окиснюється. Для того щоб визначити, чи є реакція, зокрема за участю складних речовин, окисно-відновною, використовують термін «ступінь окиснення хімічного елемента». Про нього ви можете дізнатися з текстового фрагмента за покликанням у QR-коді (https://h8.academiabook.club/p-42-text-1.html).

Теорію окисно-відновних реакцій, яку було названо електронно-йонною теорією, розробив у 1914 р. вітчизняний науковець Л. Писаржевський.
Лев Писаржевський (1874—1938)

(1914).
таку особливість окисно-відновної реакції: скільки електронів втрачають частинки одного реагенту, стільки ж їх приєднують частинки другого реагенту. Перевірте це, використавши рівняння реакцій кальцію з киснем і літію

Перевірмо себе
1. Охарактеризуйте зміни, які відбуваються
металу, що бере участь у хімічній реакції.
2. Напишіть рівняння реакції натрію з хлором. Які частинки речовин втрачають електрони, а які — приєднують? Назвіть окисник і відновник.
3. Відшукайте в ряду активності метали, утворені елементами 3-го періоду. Як змінюється їхня хімічна активність залежно від розміщення відповідних елементів у
Поміркуймо
4.
Виконаймо вправу
5. Складіть
6. Запишіть замість крапок, скільки електронів приєднують
та відновлення: а) 2F– … F2; б) Fe3+ … Fe2+. t
7. Перетворіть схему реакції CuO Cu2O + O2 на хімічне рівняння. Чи є ця реакція окисно-відновною? Якщо так, то назвіть частинкуокисник і частинку-відновник.
8.* Визначте, якого металу — магнію чи алюмінію — буде витрачено менше в реакції з хлоридною

Експериментуємо в хімічному кабінеті/лабораторії ДОСЛІДЖУЄМО ХІМІЧНІ ВЛАСТИВОСТІ МЕТАЛІВ
Вам видано метали — мідь, залізо, цинк, магній (шматочки дроту, стружка, гранули), розведену водою йодну настоянку (спиртовий розчин йоду І2), хлоридну кислоту (водний розчин хлороводню HCl з його масовою часткою 10 %), водний розчин речовини CuCl2, штатив із пробірками, пінцет, пробіркотримач, спиртівку або сухе пальне, керамічну підставку, сірники. Виконайте запропоновані досліди, дотримуючись правил безпеки. Спостереження, хімічні рівняння і висновки запишіть у зошит.
Дослід 1 Візьміть пінцетом мідну
тину полум’я спиртівки чи
ефект свідчить про перебіг
рівняння реакції
до уваги,
Помістіть в одну пробірку
у другу — стружку заліза і додайте до кожного металу йодну настоянку об’ємом 1—2 мл. Чи помічаєте зміни в пробірках?
Нагрійте кілька разів вміст кожної пробірки, але не до кипіння рідини. Що спостерігаєте?
Складіть хімічні рівняння. Візьміть до уваги, що продукт однієї реакції має формулу CuI, а другої — FeI2. Укажіть процеси окиснення і відновлення.
Дослід 3 Помістіть в одну пробірку гранулу

Дізнаєтеся, зрозумієте, використаєте
Яку сировину використовують для одержання металів?
Чому перетворення руди на метал є окисно-відновною реакцією?
Чим різняться виробництва чавуну і сталі?
Як видобували метали раніше. Ремесло, на основі якого зародилася металургія, виникло кілька тисяч років тому. Люди виявили в одержаних ними міді, свинці, олові, залізі властивості, які зумовили використання цих металів. Протягом століть створювалися дрібні
виробництва (мал. 114). Вони були й на території сучасної
початку ХІХ ст. (мал. 115).

Мал. 114.

Мал. 115.
піч (Івано-Франківщина), у якій виплавляли чавун двісті
тому Метали одержували переробленням природної сировини — оксидів (§ 8) і сульфідів (§ 20). Таку сировину називають рудою
містяться катіони металічного елемента, то необхідно
здійснювати їх відновлення:

Перетворіть наведені схеми реакцій на хімічні рівняння.
Сучасна металургія. Галузь промисловості, основою якої є видобування металів із природної сировини, називають металургією. Розрізняють чорну і кольорову металургію. Продукцією чорної металургії є залізо та його сплави — чавун і сталь, а кольорової — решта металів. Чи узгоджуються назви «чорна металургія», «кольорова металургія» з кольорами металів?

Найбільше у світі виробляють заліза
чорною металургією. Вона посідає 3-тє місце у світі з експорту чавуну і 10-те
Юзівському (нині — Донецькому) металургійному заводі. Найбільшим вітчизняним підприємством чорної металургії є металургійний комбінат «АрселорМіттал Кривий Ріг» (мал. 116). Його виробничі потужності розраховані на щорічний випуск понад 6 млн т сталі та понад 5,5 млн т чавуну.








Fe3+ + 3e – Fe; Fe2+ + 2e – Fe. Магнетит

логією. Цей спосіб одержання
ди металічних елементів. Із руд, які називають поліметалічними, одержують кілька металів. Основними компонентами, наприклад свинцево-цинкової руди, є сульфіди PbS і ZnS. Технологія перероблення такої руди досить складна.
Металічні руди — невідновлюваний природний ресурс. Тому переробляти їх потрібно якомога повніше з вилученням домішок, із яких можна одержати рідкісні й дорогоцінні метали.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про одержання металів
та хімічні основи металургії. Сформулюйте цікаве запитання за темою параграфа

3. Титан одержують у промисловості за реакцією
хлориду з магнієм, яка відбувається за високої температури. Складіть рівняння цієї реакції. Який хімічний елемент є окисником, а який — відновником?
Виконаймо вправу
4.* Схема однієї з реакцій, які відбуваються в процесі виробництва сталі, — CaO + Fe3P + O2 Ca(PO3)2 + Fe.
Перетворіть її на хімічне рівняння.
Розв’язуймо задачу
5. Масова частка Феруму
Дізнаєтеся, зрозумієте, використаєте
Який склад мають поширені металеві сплави?
Чим металеві сплави відрізняються від металів за фізичними властивостями і чим подібні до них?
У яких сферах використовують метали і металеві сплави?
Чому перероблення металевих відходів є актуальним у наш час?
Сплави металів. Твердість, пластичність, високі температури плавлення, корозійна стійкість, металічний блиск, електро- і теплопровідність — ці та інші властивості металів притаманні й металевим сплавам. Сплави виготовляють сплавлянням двох або
кількості металів.
Назви і склад найуживаніших металевих сплавів1 наведено в таблиці 8. Таблиця 8
Металеві сплави
НазваСклад (масові частки, %)
Неіржавна сталь
*Fe 67; Cr — 16—18,5; Ni — 10—14; Mo — 2—3; С 2
Бронза
(звичайна) Cu — 70—96; Sn — решта
НазваСклад (масові частки, %)
Інструментальна сталь
*Fe 95; W — 1,2—1,6; Cr — 0,9—1,2; Mn — 0,8—1,1; Si — 0,1—0,4; C — 0,9—1,05
ДюралюмінійAl — 71—90; Cu — до 13; Zn, Si, Mg — решта ЛатуньCu — 54—90; Zn — решта
НіхромNi — 77—85; Cr — 15—20; Al — решта
* Одна з марок сплаву.

Науковці/науковиці одержують і досліджують сплави з метою створення нових матеріалів з кращими механічними, фізичними та іншими властивостями, стійких до високих температур і агресивних середовищ. Про перевагу неіржавної сталі над залізом свідчить сама назва сплаву. У хімічних реакціях сплави зазвичай поводяться
відних металів. Якщо, наприклад, розігріту
тити в колбу з газом хлором, відбуватимуться реакції за участю обох металів — міді та цинку. Якщо
порошку латуні додати хлоридну кислоту, то з нею реагуватиме лише один компонент сплаву (який?).

Напишіть рівняння реакцій. Візьміть до уваги, що складниками сполук металічних елементів, які утворюються, є двозарядні катіони.
Використання металів і сплавів. На практиці найчастіше використовують залізо, алюміній, мідь та їх сплави, а також цинк. Це зумовлено їхньою стійкістю в природних умовах і
відповідних металічних руд. У яких сферах

останні десятиліття перелік металів, які застосовують у різних сферах, розширився. У виробництві перспективних хімічних джерел струму — літій-йонних акумуляторів — використовують літій. Берилій виконує функцію уповільнювача нейтронів у ядерній техніці. З титану виготовляють
використовують для протезування кісток. Літій, берилій




Мал.

вистачить не більше ніж на 170 років, а руд кольорових
40 років. Тому актуальним для світової спільноти є вирішення таких
завдань:
повне і комплексне перероблення металічних руд;
збирання і перероблення металовмісних відходів; заміна металів і металевих сплавів іншими матеріалами.
Перероблення відходів металів і сплавів порівняно з одержанням металів із руд є економічно та енергетично вигіднішим. Найбільше із металовмісних відходів виробляють заліза

Знайдіть на виробі із заліза, сплаву заліза
алюмінію знак (мал. 119), який означає, що метал або сплав може бути використаний повторно.

Метали як матеріали дедалі частіше замінюють пластмасами, які мають необхідні властивості. Це дає змогу заощадити метал, спростити процес виготовлення виробу, а сам виріб зробити дешевшим і стійкішим до речовин довкілля. Із пластмас виготовляють знаряддя праці, різноманітні труби (мал. 120), деталі до механізмів, обладнання для транспортних засобів, предмети побуту тощо.
ВИОКРЕМЛЮЄМО ОСНОВНЕ
Мал. 119. Знаки спрямування металів на перероблення

Мал. 120.
Проаналізувавши матеріал, викладений у параграфі, запишіть у зошиті висновки про металеві сплави, їхній склад, а також використання металів і сплавів.

Сформулюйте цікаве запитання за темою параграфа і поставте його своїм однокласникам/однокласницям.
Дізнаваймося
5. Перші монети незалежної
6. Для визначення густини сплаву учениця
640 мл. За результатами
Масові частки металів у спеціальній бронзі такі (у відсотках): Cu — 85, Sn — 9, Zn — 6. Атомів якого хімічного елемента в бронзі
8. Порошок силуміну (сплав
9.
раму ШІ (штучного інтелекту)? Створюймо проєкт 10. Підготуйте за
Формуймо словничок 11. Випишіть ключові слова і словосполучення з тексту
двомовний словничок із ключових слів і словосполучень,

Завершився навчальний рік, другий рік вивчення вами хімії. Ми впевнені, що на уроках із цього предмета вам було цікаво.
Ви з’ясували, яку інформацію про хімічні елементи містить періодична таблиця, і зрозуміли, наскільки важливо вміти нею користуватися. Періодична таблиця хімічних елементів ілюструє основний закон хімії — періодичний закон. Він охоплює всі хімічні елементи й поширюється на прості речовини та багато складних речовин. Ви дізналися про закон збереження маси речовин під час хімічних реакцій і про закони, яким підпорядковуються гази. Спираючись на ці закони, науковці/ науковиці досліджують речовини, їхні властивості, хімічні реакції. Вам стало відомо, що в хімії порції речовин оцінюють і порівнюють не лише за їхньою масою чи об’ємом,
кількістю найменших частинок. Уже не є для вас секретом склад
та їхня електронна будова, з’ясувати яку допомагає відповідна модель.
знаєте,
і чому сполучаються одна з одною найменші частинки речовин, а також як утворюються йони з атомів. Читаючи
талів і
допомогою моделі «кристалічні ґратки» переконалися, що
Сподіваємося, що кожний із вас навчився складати формули складних речовин, а також розв’язувати задачі різних типів.
Виконуючи лабораторні експерименти, ви вдосконалювали навички з дослідження речовин та їхніх властивостей, осмислювали отримані результати й робили висновки.
Матеріал з хімії в 9 класі теж буде цікавим. Ви поглибите свої уявлення про розчини, дізнаєтеся про основні класи неорганічних речовин, ознайомитеся з найважливішими органічними речовинами, зокрема й тими,
§ 2. № 10. NO2.
§ 6. № 7. Речовина розклалася неповністю.
§ 7. № 5. Тиск зменшився в колбі, в якій спалювали магній.
§ 9. № 5. 4СnHm + (4n + m)O2 = 4nCO2 + 2mH2O.
§ 10. № 5. w(O3) = 23,1 %.
§ 11. № 4. m(O2) = 2,985 г.
№ 7. 913 млрд.
§ 14. № 7. а) n(CH4) = 1 моль; б) n(CH4) = 0,3 моль.
§ 15. № 8. m = 30 г.
№ 9. Найбільше атомів у мідному кубику, найменше — у свинцевому.
№ 10. а) більше молекул у воді; б) більше молекул у воді.
§ 16. № 5. m(CO2) = 982 г.
№ 8. V(H2) : V(CH4) = 8 : 1.
§ 17. № 4. V(NO2) = 4 л; V(O2) = 1 л.
№ 5. V(O2) = 20 мл; V(Н2) = 20 мл.
№ 7. V(O2) = 100 мл.
№ 8. N2H4.
§ 18. № 7. (пов.) = 1,295 г/л.
№ 8. Mr(A) = 46.
№ 9. Газ важчий за метан в 1,07 раза.
№ 10. (Х) = 1,875 г/л; DY(X) = 1,62.
№ 11. DN2(газу) = 1,57.
§ 19. № 6. n(O2) = 0,125 моль.
№ 7. m(CaCO3) = 15 г.
№ 8. V(газів) = 3,36 л.
№ 9. Не вся речовина розклалася.
§ 20. № 4. V(O2) = 5,6 л.
№ 5. а) Залишиться частина сірки; б) не залишиться жодного реагенту.
§ 25. № 8. As.
№ 9. Скандій.
№ 10. N(e–) = 3,6 · 1021.
§ 26. № 2. б.
№ 4. 9 різновидів молекул.
№ 7. Ar(Mg) = 24,3.
№ 8. Галій-71.
§ 28. № 7. В.
§ 29. № 2. Спарених електронів — 4.
№ 7. Один елемент міститься в 2-му періоді, другий — у 3-му періоді.
§ 30. № 4. Один елемент міститься в кінці періоду, другий — на початку іншого періоду.
№ 5. б.
§ 31. № 6. Молекула має форму восьмикутника.
§ 32. № 5. Візьміть до уваги орієнтацію р-орбіталей.
§ 33. № 5. а) OF2; б) N2O3.
№ 6. Валентність Хлору — 7.
§ 35. № 7. а.
§ 37. № 6. У йона Магнію найменший радіус, у йона Флуору — найбільший.
№ 11. Серед цих йонів — Al3+ і N3–.
§ 38. № 4. б) Sr(OH)2; д) (NH4)2SO4.
№ 5. Візьміть до уваги заряди і радіуси йонів.
№ 8. w(Mg) в Mg3N2 = 72 %; w(Mg) в Mg(OH)2 = 41,4 %.
§ 39. № 4. а) Шість йонів Cl–; б) шість йонів Na+.
§ 42. № 8. V(H2) = 3,36 л.
§ 43. № 4. Візьміть до уваги, що ліворуч має бути парна кількість атомів Оксигену. Рекомендуємо почати добір коефіцієнтів з першого реагенту.
№ 5. w(дом.) = 20 %.
№ 6. w(C) = 1,25 %. Порошок виготовлено зі сталі.
§ 44. № 8. На 10 атомів Sn припадає 176 атомів Cu.
№ 9. w(SiO2) = 15,6 %; w(Al2O3) = 84,4 %.
Аморфна речовина — тверда речовина, у якій найменші частинки розміщені хаотично.
Аніон — негативно заряджений йон.
Атом — найменша електронейтральна частинка речовини, яка складається з позитивно зарядженого ядра і негативно заряджених електронів, що рухаються навколо нього.
Валентні електрони — електрони, які можуть брати участь в утворенні хімічного зв’язку.
Валентність — здатність атомів хімічного елемента сполучатися з певною кількістю таких самих або інших атомів.
Відновлення
Відновник
Водневий зв’язок — електростатична взаємодія між молекулами
елементів.
Галогени — елементи головної підгрупи VII групи періодичної таблиці1 (Флуор, Хлор, Бром, Йод), а також відповідні прості речовини.
Горіння — хімічна реакція, унаслідок якої виділяється теплота і з’являється полум’я.
Графічна формула — формула молекули, у якій спільні пари електронів позначено рисками.
Група (елементів) — стовпчик хімічних елементів у періодичній таблиці.
Делокалізовані електрони — електрони,
металі. Диполь — частинка, що
Електронегативність — властивість атома хімічного елемента зміщувати у свій бік пару електронів, спільну з іншим атомом.
Електронна формула — запис, який відображає електронну будову атома, йона чи молекули.
Ендотермічна реакція — реакція, під час якої поглинається теплота.
Енергетичний рівень — фрагмент моделі атома, який об’єднує електрони з майже однаковою енергією.
Зовнішні електрони — електрони останнього енергетичного рівня атома.
Ізотопи — види атомів хімічного елемента з різною кількістю нейтронів.
Інертні елементи — елементи головної підгрупи VIII групи періодичної таблиці1 (Гелій, Неон, Аргон, Криптон, Ксенон, Радон). Прості речовини цих елементів називають інертними газами.
Істинна формула — формула, яка показує реальний склад молекули.
Йон — заряджена частинка, яка утворюється з атома внаслідок втрати або приєднання ним одного чи кількох електронів.
Йонний зв’язок — зв’язок між протилежно зарядженими йонами.
Каталізатор — речовина, яка
продуктом.
Катіон — позитивно заряджений йон.
Кількість речовини — фізична величина, яка визначається кількістю атомів, молекул, груп атомів або йонів у певній порції речовини.
Ковалентний зв’язок — зв’язок між атомами, зумовлений утворенням спільних пар електронів.
Колообіг елемента — сукупність процесів у природі, під час яких атоми хімічного елемента внаслідок хімічних реакцій «переходять» від одних речовин до інших.
Колообіг речовини — сукупність процесів у природі,
таблиці1 (Літій, Натрій, Калій, Рубідій, Цезій, Францій). Прості речовини цих елементів називають лужними металами.
Металічний зв’язок — зв’язок між катіонами в металі, здійснюваний делокалізованими електронами.
Молекула — частинка, яка складається з двох або більшої кількості сполучених атомів.
Моль — одиниця вимірювання кількості речовини; порція речовини, яка містить 6,02 · 1023 атомів, молекул або наявних у її хімічній формулі груп атомів чи йонів.
Молярна маса — маса 1 моль речовини.
Молярний об’єм — об’єм 1 моль речовини.
Найпростіша формула — формула, яка відображає відношення кількості атомів або йонів у сполуці.
Нейтрон — електронейтральна частинка, складник ядра атома.
Неполярний ковалентний зв’язок — ковалентний зв’язок, у якому одна чи кілька спільних пар електронів не зміщені в бік одного з атомів.
Нормальні умови — температура 0 С і тиск 760 мм рт. ст. (101,3 кПа).
Нуклід — будь-який вид атомів.
Нуклон — загальна назва частинок (протона і нейтрона), з яких складаються ядра атомів.
Нуклонне число — сумарна кількість протонів і нейтронів в атомі.
Окиснення — процес втрати електронів речовиною або її частинкою. Окисник — речовина або частинка, яка приєднує електрони.
Оксид — сполука, утворена двома хімічними елементами, одним з яких є Оксиген.
Окисно-відновна реакція
реакція,
час якої реагенти обмінюються електронами.
Орбіталь — частина простору атома, у якій перебування електрона є найбільш
Полярний ковалентний зв’язок — ковалентний зв’язок, у якому одна чи кілька спільних пар електронів зміщені в бік одного з атомів.
Потрійний зв’язок — зв’язок, утворений трьома спільними парами електронів.
Проста речовина — речовина, утворена одним хімічним елементом.
Простий ковалентний зв’язок — зв’язок, утворений однією спільною парою електронів.
Протон — позитивно заряджена частинка, складник ядра атома.
Протонне число — кількість протонів в атомі.
Радіоактивність — явище самочинного перетворення атомів хімічного елемента на атоми іншого елемента.
Радіонуклід — радіоактивний нуклід.
Радіус атома — відстань від центра ядра до сферичної поверхні, якої «торкаються» орбіталі з електронами останнього енергетичного рівня.
Реакція розкладу — реакція, під час якої з однієї речовини утворюється кілька речовин.
Реакція сполучення — реакція, під час якої з кількох речовин утворюється одна речовина.
Руда — природна речовина або суміш речовин, з якої видобувають метал (метали).
Ряд активності металів — ряд, у якому метали розміщені за зменшенням хімічної активності.
Складна речовина — речовина, утворена двома або більшою кількістю хімічних елементів.
Стала Авогадро — 6,02 · 1023 моль–1.
Сублімація — перетворення твердої речовини
газ, минаючи рідкий стан.
Хімічне рівняння — запис хімічної реакції за допомогою формул реагентів і продуктів, який відповідає закону збереження маси речовин під час реакції.
Хімічний елемент — вид атомів з певним зарядом ядра (протонним числом).
Хімічний зв’язок — взаємодія між атомами, молекулами, йонами, унаслідок якої частинки утримуються разом.
1. Обчислення кількості речовини
2. Обчислення молярної
3. Обчислення відношення
A, B
V(A) : V(B) : V(C) = a : b : c.
C є
4. Обчислення
А
Аморфна речовина 200
Аніон 190
Атом 6
Атомна частка 138
Валентність 172
Відновлення 216
Відновник 216
Відносна густина газу 96
Внутрішня енергія речовини 70
Г
Галогени 118, 119
Горіння 48
Група (періодичної таблиці) 127
Диполь 185
Е
Електронегативність 181
Електрон 131, 133, 146
Електрони
делокалізовані 207
зовнішні 152
неспарені 147
спарені 147
Електронна оболонка 147
Електронна формула
атома 148
молекули 164
Електронний октет 162
Елементи
інертні 119
лужні 119
металічні 14, 206
неметалічні 14
Енергетичний
рівень 147
Закон
простий 165 ПРЕДМЕТНИЙ
підрівень 148
Авогадро 87
Гей-Люссака 92
збереження маси речовин
під час реакції 23
Зв’язок
водневий 186
йонний 195
ковалентний 163
металічний 207
неполярний 183
подвійний 165
полярний 183
потрійний 165
Ізотопи 137, 138
Інертні гази 119
Йон 190
Каталізатор 32
Катіон 190
Кількість речовини 75
Колообіг
речовини 59
хімічного елемента 59
Корозія 63
Кристал 200
Кристалічні ґратки 201
Лужні метали 118
Модель молекули
кулестержнева 167
масштабна 167
Молекула 8
Моль 75
Молярна маса 81
Молярний об’єм 86
Н
Нейтрон 132, 133
Нормальні умови 86
Нуклід 138
Нуклони 132
Нуклонне число 134
Озоновий шар 56
Окиснення 50, 216
Окисник 216
Оксиди 45
назви 45
поширеність 46
формули 45
Орбіталь 146
Період 127
Періодична таблиця 126
довгий варіант 126
короткий варіант 126
Періодичний закон 124, 125
Підгрупа
головна 127
побічна 127
Полярність молекули 185
Правило
електронейтральності 195
«октав» 120
Принцип
мінімальної енергії 147
Природний ряд хімічних
елементів 124
Протон 132, 133
Протонне число 133 Р
Радіоактивність 141
Радіонуклід 141
Радіус атома 157
Реакція
екзотермічна 71
ендотермічна 71
окисно-відновна 216
розкладу 32
сполучення 39
Руда 221
Ряд активності металів 214
С
Спін електрона 147
Стала Авогадро 76
Сублімація 177
Сульфіди 107
Схема хімічної реакції 26
Т
Термохімічне рівняння 71
Ф
Феромагнетик 211
Формула молекули
графічна 164
електронна 164
істинна 176
найпростіша 176
Х
Хімічне рівняння 27
Хімічний елемент 8, 133
Ш
Швидкість хімічної реакції 111
Я
Ядро атома 132
Бобкова О. С. Хімія — це цікаво! : навч. посіб. для 7—11 кл. загальноосвіт. навч. закл. / О. С. Бобкова. — Київ : УОВЦ «Оріон», 2019. — 72 с.
Богданова В. Я. Хімічні реакції навколо нас : посіб. серії «Шкільна бібліотека» для 7 класу закл. загал. серед. освіти / В. Я. Богданова. — Харків : Ранок, 2020. — 112 с.
Василега М. Д. Цікава хімія / М. Д. Василега. — Київ : Рад. шк., 1989. — 188 с.
Вороненко Т. І. Хімія щодня. Це треба знати кожному / Тетяна Вороненко, Тетяна Іваха. — Київ : Шк. світ, 2011. — 128 с.
Ґонік Л. Хімія / Ларрі Ґонік, Крейґ Кріддл ; пер. з англ. — Київ : Рідна мова, 2022. — 256 с. (Серія «Наука в коміксах»).
Кін Сем. Ложка, що зникає: правдиві розповіді з періодичної системи хімічних елементів про безумство, кохання та історію світу / Сем Кін ; пер. з англ. Е. Рабинович. — Харків : ВД «Фабула», 2021. — 352 с. Ковтун Г. Таємничий світ молекул: Матеріали до уроків / Григорій Ковтун. — Київ : Шк. світ, 2006. — 120 с.
Котляр З. В. Хімія елементів / З. В. Котляр, В. М. Котляр. — Київ : Вид. дім «Перше вересня», 2016. — 224 с.
Крівелліні М. Хімія огидних речей. Експериментуймо! / Маттіа Крівелліні, Валерія Бараттіні, Франческа Горіні ; пер. з англ. А. Ващук. — Львів : Вид-во Старого Лева, 2023. — 56 с.
Лєєнсон І. А. Дивовижна хімія / І. А. Лєєнсон. — Харків : Ранок, 2011. — 176 с.
Саркісян В. Дослідники смерті. Від Шерлока Голмса та Агати Крісті до лабораторії судмедексперта / Володимир Саркісян. — Київ : Віхола, 2024. — 200 с.
Саркісян В. Хімія повсякдення. Від шампуню і прального порошку до смаженої картоплі / Володимир Саркісян. — Київ : Віхола, 2021. — 176 с. Смаль Ю. Вибухова історія людства.
: Вид-во Старого Лева, 2016. — 112 с.
Інтернет-сайти, які
цікавий матеріал з хімії
1. http://www.thoughtco.com/chemistry-4133594
2. https://www.facebook.com/compoundchem
3. https://www.webelements.com
4. https://www.chemistryworld.com
5. https://www.compoundchem.com
6. https://www.facebook.com/chemistryislove1
7. https://www.facebook.com/groups/309370026343306 (Хімія — це цікаво)
8. https://www.facebook.com/groups/330993341097761 (Цікава хімія)
Хімічний
Стартуємо.
§ 1. Атоми. Хімічні елементи. Молекули
§ 2. Прості та складні речовини
§ 3. Властивості та
§ 4. Закон збереження
§ 9. Процеси горіння та
Експериментуємо в хімічному
кабінеті/лабораторії
Досліджуємо горіння свічки (експеримент для групи)
Експериментуємо вдома Гасимо полум’я
§ 10. Озон
§ 11. Колообіги кисню та Оксигену
роль і
Експериментуємо вдома
§ 13. Тепловий
§ 18.
§ 19. Обчислення
§ 24. Періодична таблиця хімічних елементів ............................126
§ 25. Склад атомів ..................................................................131
§ 26. Ізотопи ..........................................................................136
§ 27. Радіоактивність. Радіонукліди .........................................141
§ 28. Електрон. Атомні орбіталі.
Енергія електронів в атомі ...............................................145
§ 29. Електронна будова атомів ................................................151
§ 30. Радіуси атомів ................................................................157
§ 31. Будова молекул простих речовин.
Ковалентний зв’язок .......................................................161
§ 32. Будова молекул складних речовин
Експериментуємо після уроків Виготовляємо моделі молекул ..............................171
§ 33. Валентність хімічних елементів
§ 34. Речовини молекулярної та атомної будови
§ 35. Електронегативність хімічних елементів. Полярний і неполярний
§ 36. Водневий
Розділ 4.
ДОСЛІДЖУЄМО БУДОВУ
§ 40. Метали. Металічний зв’язок
§ 41. Фізичні властивості металів
Експериментуємо в хімічному
кабінеті/лабораторії
Досліджуємо фізичні
§ 42. Метали як реагенти. Окисно-відновні
Експериментуємо в хімічному
кабінеті/лабораторії Досліджуємо хімічні
Експериментуємо
