https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html









































































































1.1
1.2
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
змінюється форма, агрегатний стан, розміри речовини.
відбуваються зміни.
змінюється склад, утворюються нові речовини.
shkola.in.ua
1.3

1. Утворення або поглинання газу.
2. Утворення або зникнення осаду.
3. Зміна смаку.
4. Зміна кольору.
5. Зміна запаху.
6. Виділення або
поглинання температури.
7. Випромінювання або поглинання світла.

https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html

https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
1.6 Прочитайте
відповідними літерами.
A – деревна тирса (спливає на поверхні води).
B – глина (залишається нерозчиненою у воді).
C – кухонна сіль (розчиняється у воді). shkola.in.ua
D – залізні ошурки (відділяються магнітом).
Сторінка 5
2.1 Доповни визначення йонів Йони — це
заряд:
2.3
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Cl⁻ O²⁻ N³⁻
K⁺ KCl K₂O K₃N
Ca²⁺ CaCl₂ CaO Ca₃N₂
Al³⁺ AlCl₃ Al₂O₃ AlN
Сторінка 6
2.4 Гра «Хрестики й нулики».
сполук.
shkola.in.ua
2.5 Запишіть назви речовин
Na₂O натрій оксид
MgS — магній сульфід
AlP — алюміній фосфід
P₂O₃ — фосфор(III) оксид
SnS₂ — станум(IV) сульфід
MgO — магній оксид
K₂O — калій оксид
MgCl₂ магній хлорид
shkola.in.ua
2.6 Запишіть формули сполук.
калій оксид K₂O
сульфур(VI) оксид — SO₃
фосфор(V) оксид — P₂O₅
кальцій сульфід — CaS
фосфор(III) оксид — P₂O₃
арґентум(1+) фосфід — Ag₃P
ферум(2+) бромід — FeBr₂
арсен(V) оксид As₂O₅
GaBr₃ галій бромід
CS₂ — карбон дисульфід
MnS — манган(II) сульфід
CuCl₂ — купрум(II) хлорид
BaI₂ — барій йодид
Mg₃P₂ — магній фосфід
Ca₃P₂ — кальцій фосфід
LiBr літій бромід
купрум(1+) нітрид Cu₃N
манган(2+) фторид — MnF₂
хром(3+) сульфід — Cr₂S₃
цинк оксид — ZnO
ауром(3+) оксид — Au₂O₃
бром(V) оксид — Br₂O₅
ванадій(3+) сульфід — V₂S₃
плюмбум(2+) нітрид Pb₃N₂ shkola.in.ua
2.7
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
амоніак — NH₃ (Гідроген + Нітроген)
фосфін — PH₃ (Гідроген + Фосфор)
арсин — AsH₃ (Гідроген + Арсен)
стибін — SbH₃ (Гідроген + Стибій) shkola.in.ua
2.9 Підкресліть формули речовин, які за наведеними
окиснення) хімічних елементів складено
правильні.
Неправильно Правильно
SiO₄ SiO₂
NaO Na₂O
CS CS₂ shkola.in.ua
2.10
формулах речовин.
Cr₂O₃ → Cr³⁺ O²⁻
SF₆ → S⁶⁺ F⁻
Ca₃P₂ → Ca²⁺ P³⁻
Al₄C₃ → Al³⁺ C⁴⁻
CaF₂ → Ca²⁺ F⁻
PCl₅ → P⁵⁺ Cl⁻
CuO → Cu²⁺ O²⁻
NO₂ → N⁴⁺ O²⁻
HF → H⁺ F⁻
SiO₂ → Si⁴⁺ O²⁻ shkola.in.ua
8
Cl₂O₇ → Cl⁷⁺ O²⁻
MnO₂ → Mn⁴⁺ O²⁻
H₂Se → H⁺ Se²⁻
Cu₂O → Cu⁺ O²⁻
Na₂O → Na⁺ O²⁻
HCl → H⁺ Cl⁻
I₂O₅ → I⁵⁺ O²⁻
K₂S → K⁺ S²⁻
CCl₄ → C⁴⁺ Cl⁻
NaCl → Na⁺ Cl⁻
FeCl₃ → Fe³⁺ Cl⁻
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
3.3
3.4
He, F, Zn, K, N, S, Ca, Cl, B, Fe.
Розв’язання (Ar): He 4; B 11; N 14; F 19; S 32; Cl 35; K 39; Ca 40; Fe 56; Zn 65.
Сторінка 9
3.5
разів.
Розв’язання (Ar): He = 4, N = 14, O = 16, S = 32, Fe = 56, Si = 28, C = 12, Cu = 64, Ca = 40, Na = 23, Li = 7) Пара елементів Порівняння Ar
Ar(C) > Ar(He) 12 / 4 =
(Ar): Cu = 64, C = 12, O = 16, P = 31, Si = 28, Cr = 52, Mn = 55, F = 19, Ne = 20, Ag = 108, Hg = 201. shkola.in.ua
= 4·19 = 76 > 3·Ar(Ne) = 3·20 = 60
= 6·108 = 648 > 3·Ar(Hg) = 3·201 = 603
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 10
3.8
показує,
маса атома більшa за 1/12 маси атома Карбону-12.
дорівнює сумі відносних атомних мас усіх атомів у молекулі. - відносні, - не мають одиниць, - використовуються для обчислень у хімії.
shkola.in.ua
shkola.in.ua
3.9
Розв’язання (Ar): H=1, C=12, N=14, O=16, Na=23, Mg=24, Al=27, Si=28, P=31, S=32, Cl=35, K=39, Ca=40, Cr=52, Cu=64, Ag=108):
Mr(Cl₂) = 2·35 = 70 shkola in ua
Mr(CaO) = 40 + 16 = 56
Mr(H₂S) = 2·1 + 32 = 34
Mr(CaSO₄) = 40 + 32 + 4·16 = 136
Mr(CaCO₃) = 40 + 12 + 3·16 = 100
Mr(H₂SO₄) = 2·1 + 32 + 4·16 = 98
Mr(K₂SO₄) = 2·39 + 32 + 4·16 = 174
Mr(Na₃PO₄) = 3·23 + 31 + 4·16 = 164
Mr(Cu(NO₃)₂) = 64 + 2·(14 + 3·16) = 64 + 2·62 = 188
Mr(Cr₂(SO₄)₃) = 2·52 + 3·(32 + 4·16) = 104 + 3·96 = 392
Mr(Ag(NH₃)₂OH) = 108 + 2·(14 + 3·1) + (16 + 1) = 108 + 34 + 17 = 159
Ar: C = 12, H = 1.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Розв’язання: Відношення
Mr(HO) = 1 + 16 = 17.
Mr(H₂O₂) = 2 · 17 = 34. shkola in ua 34 : 17 = 2, отже у
(Fe, Ar = 56)
FeS: Mr = 56 + 32 = 88 (не підходить, бо в умові Mr = 120).
FeS₂: Mr = 56 + 2·32 = 56 + 64 = 120. shkola in ua
Відповідь: формула піриту — FeS₂.
3.13 Прочитайте завдання №24 у
молекулярну масу жасмоналю.
Розв’язання:
Формула жасмоналю: C₆H₅CHC(C₅H₁₁)CHO.
Підрахуємо кількість атомів: C = 14, H = 18, O = 1. shkola.in.ua
Mr = 14·12 + 18·1 + 16 = 168 + 18 + 16 = 202.
Відповідь: Mr(C₁₄H₁₈O) = 202.
3.14 Закріпимо нові знання.
Сторінка 12
4. Масова частка хімічного
(S, Ar = 32).
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
NO₂ shkola
ω(���� ) ≈ 55,2%; ω(���� ) ≈ 14,6%; ω(
7) Na₂SO₄
8)
9) Ca(NO₃)₂ �������� (��������(��������3 )2 ) = 40 +2 ⋅ (14 +3 ⋅ 16) =
1. C6H12O6
2. C12H22O11
Обчислити:
ω(O) — ? shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо: ��������3 Розв’язання: shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо: ����(��������2 ����3 ) = 1т = = 1000 кг
Обчислити: ����(��������) — ?
Розв’язання: shkola.in.ua
�������� (��������2 ����3 ) =2 ⋅�������� (�������� ) +3 ⋅�������� (����) =2 ⋅ 56 +3 ⋅ 16 = 112 + 48 = 160 Обчислимо масову
ω(�������� ) = 2 ⋅�������� (�������� ) �������� (��������2 ����3 ) = 112 160 =0,7 або 70%
відбуваються технологічні втрати.
Додатково:
Назва гематит походить від грец. haima — «кров»,
назви
орнаментів
Сторінка 14
4.8 Обчисліть
Pb �������� (������������) = 207 + 16 = 223
(�������� ) = 207 223 ⋅ 100%
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Crx Oy
1. Визначимо відносну формульну масу сполуки:
�������� = ����(Cr) ⋅�������� (Cr) ���� (Cr) = 1 ⋅ 52 0,52 = 100
2. Маса Оксигену: shkola in ua
100 52 = 48
3. Число атомів Оксигену:
48 ∶ 16 =3
Відповідь: CrO3 .
5.2 Визначте хімічну формулу
Оксигену становить 63,2%.
Відомо: ���� (O) = 63,2% =0,632
Необхідно визначити: хімічну формулу сполуки.
Nx Oy
1. Визначимо відносну формульну масу сполуки: �������� = ����(O) ⋅�������� (O) ���� (O) = 1 ⋅ 16 0,632 = 25,32
2. Маса Нітрогену: shkola.in.ua 25,32 16 =9,32
3. Число атомів Нітрогену: 9,32 ∶ 14 =0,665 (дробове)
4. Домножуємо індекси на 3 → N2 O3 .
Відповідь: N2 O3
5.3 Визначте хімічну формулу
становить 81,82%.
Відомо: ���� (C) = 81,82% =0,8182.
визначити:
Cx Hy
1. Визначимо відносну
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
�������� = 184.
Cux Fey Sz
1.
2. Для Феруму:
3. Для Сульфуру:
shkola.in.ua
формула
1. Для Феруму: shkola.in.ua
232.
2.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
(Al) = 52,9%
1.
2.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Відомо:
���� (Me) = 60% =0,60. �������� = 100 (беремо умовно, бо не задано).
Необхідно визначити: хімічну формулу сполуки.
Mex Oy
1. Для металічного елемента: shkola.in.ua
����(Me) = 100 ⋅���� (Me) �������� (Me)
Припустимо, що цим металом є Магній (�������� (Mg) = 24): ����(Mg) = 100 ⋅ 0,60 24 = 60 24 =2,5
2. Для Оксигену: w(O) =1 w(Me) =1 0,60 =0,40
����(O) = 100 ⋅���� (O) �������� (O) = 100 ⋅
3. Відношення атомів 2,5 : 2,5 = 1 : 1. Відповідь: формула сполуки MgO. Назва:
Сторінка 17 6. Кількість речовини. Молярна
6.1 Основні поняття:
Кількість речовини (n) —
частинок (атомів, молекул, йонів) у
Позначається: (n). shkola.in.ua
Одиниця вимірювання: моль (моль).
1 моль — це кількість речовини, яка містить
Число Авогадро (�������� ) — кількість частинок в 1
речовини. �������� =6.02 ⋅ 1023 частинок/моль
Молярна маса (M) —
Позначається: M.
Одиниця вимірювання: г/моль.
Чисельно дорівнює відносній
Відносна молекулярна маса (�������� ) —
6.5
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
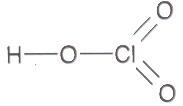
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
сама кількість молекул.
Кисень
Хімічна формула: ����2
Молярна маса:
���� (����2 ) =2 ⋅�������� (���� ) =2 ⋅ 16 = 32 г/моль
Кількість речовини:
����(����2 ) = ���� ���� = 48 32 =1.5 моль shkola.in.ua
Сірка
Хімічна формула: ����8
Кількість речовини:
����(����8 ) = ����(����2 ) =1.5 моль
Молярна маса:
���� (����8 ) =8 ⋅�������� (����) =8 ⋅ 32 = 256 г/моль
Маса:
����(����8 ) = ����⋅���� =1.5 ⋅ 256 = 384 г
Відповідь: маса сірки становить

https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
сульфіду кількістю речовини 1 моль.
Відомо:
����(FeS) = 1моль
����(Fe) ?
����(S) — ?
����(Fe)
���� (S) —?
Розв’язання:
Рівняння реакції:
Fe +S → FeS
За рівнянням: shkola.in.ua
����(Fe) ∶����(S) =1 ∶ 1
Коефіцієнти 1 і 1 ⇒ змішувати у рівних кількостях речовини.
Для ����(FeS) =1 моль маємо: ����(Fe) = 1 моль, ����(S) = 1 моль.
Маси реактантів:
����(Fe) = ����(Fe) ⋅���� (Fe), ����(S) = ����(S) ⋅���� (S)
���� (Fe) = �������� (Fe) = 56 г/моль, ���� (S) = �������� (S) = 32 г/моль ����(Fe) =1 ⋅ 56 = 56 г, ����(S) =1 ⋅ 32 = 32 г
Відповідь: змішувати у відношенні ����(Fe) ∶����(S) =1 ∶ 1. Для добування 1 моль FeS потрібно ����(Fe) = 56 г і ����(S) = 32 г.
Сторінка 23
8.1
(N₂) 78 %
(O₂) 21 % shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Сторінка 27
9.5
- Отримують малі кількості речовини;
- Потрібні невеликі реактори, пробірки;
- Використовується для навчання і дослідів;
- Реакції короткотривалі, контроль простий.
Сторінка 28
9.7
Промисловий спосіб
- Отримують великі обсяги речовини;
- Використовують великі установки, тиск, каталізатори; - Використовується для виробництва; - Реакції безперервні, контроль автоматичний. - Відбуваються ті самі хімічні реакції; - Потребують вихідних речовин і енергії; - Обидва способи мають на меті одержати певну чисту речовину
shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
теплове випромінювання. shkola.in.ua
③ Які є обмеження
тощо). ① Зробіть підписи до малюнків.
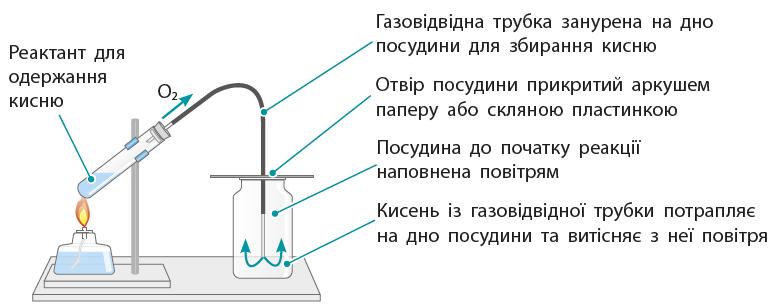
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
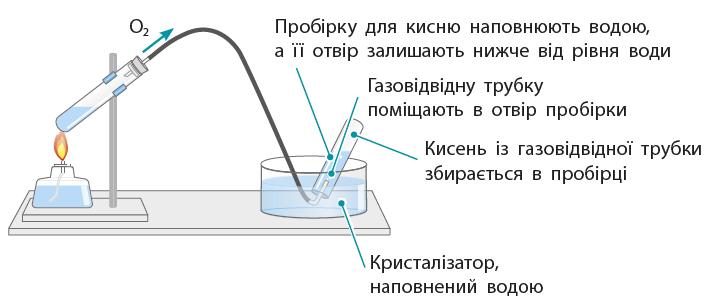
shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
2Mg + O₂ → 2MgO
4P + 5O₂ → 2P₂O₅
2CO + O₂ → 2CO₂
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Повільне окиснення
- реакції окиснення; - участь кисню; - виділення енергії (тепла); - утворюються продукти-оксиди
багато тепла й світла. - повільна реакція; - без полум’я; - виділяється небагато тепла.
shkola.in.ua
Горіння
- швидке, але не миттєве; - полум’я звичайне; - виділення газів помірне.
shkola.in.ua

10.7
10.8
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
10.9

2�������� + ����2 → 2��������2
35 10.12
CH4 +2O2 →CO2 +2H2 O б) 2C2 H6 +7O2 →4CO2 +6H2 O в) SiH4 +2O2 →SiO2 +2H2 O
C6 H12 O6 +6O2 →6CO2 +6H2 O д) C2 H5 OH+3O2
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
а) H₂S + 3O₂ = SO₂ + H₂O 2H₂S + 3O₂ → 2SO₂ + 2H₂O
б) CuO + HCl = CuCl₂ + H₂O CuO + 2HCl → CuCl₂ + H₂O
в) ZnS + O = ZnO + SO₂ 2ZnS + 3O₂ → 2ZnO + 2SO₂
г) Ca + Br₂ = CaBr
Ca + Br₂ → CaBr₂
Відомо:
Аргентум(1+)
оксид Ag 2 O,
Меркурій(2+)
оксид HgO
����1 (���� ) у Ag 2 O; ����2 (���� ) у HgO;
Розв’язання: Рівняння розкладу: 2Ag 2 O → 4Ag +O2 ,2HgO → 2Hg +O2 . �������� (Ag) = 108, �������� (Hg) = 201, �������� (O) = 16.
Молярні маси: ���� (Ag 2 O) =2�������� (Ag) + �������� (O) =2 ⋅ 108 + 16 = 232 г/моль, ���� (HgO) = �������� (Hg) + �������� (O) = 201 + 16 = 217 г/моль.
: shkola.in.ua
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
10.17 Унаслідок
оксид масою 19,2 г.
Відомо: ����(��������2 ) = 19,2 г
Обчислити:
����(����2 ) ?
shkola.in.ua
Розв’язання: Реакція: ��������2
1. ����(��������2 ) = ����(��������2 ) ���� (��������2 ) = 19,2 64 =0,3 моль
2. За рівнянням: 2��������2 утворюються з 3����2 , тобто ����(����2 ) = 3 2 ⋅����(��������2 ) = 3 2 ⋅ 0,3=0,45 моль
3. ����(����2 ) = ����(����2 ) × ���� (����2 ) =0,45 × 32 = 14,4 г
Відповідь: 14,4 г
10.18 Обчисліть масу (г) сірки, яка згоріла, якщо
Відомо:
����(����2 ) = 11,2 г
Обчислити: ����(����) ?
shkola.in.ua
Розв’язання: Реакція: ���� + ����2 →��������2
1. ����(����2 ) = ����(����2 ) ���� (����2 ) = 11,2 32 =0,35 моль
2.Зарівняннямреакції ����(����) = ����(����2 ) =0,35 моль
3. ����(����) = ����(����) × ���� (����) =0,35 × 32 = 11,2 г
Відповідь: 11,2 г
10.19 Обчисліть масу кисню, необхідного
Відомо: ����(CH4 ) = 4 г
Розв’язання: Реакція: CH4 +2O2 →CO2 +2H2 O ����(CH4 ) = ����(CH4 ) ���� (CH4 ) = 4 16 =0,25
.
https://shkola.in.ua/3353-hdz-khimiia-8-klas-hryhorovych-2025-robochyi-zoshyt.html
Живі організми: – необхідний для дихання; – забезпечує утворення енергії в клітинах. shkola.in.ua
У ракетній техніці:
як окисник пального; – забезпечує роботу ракетних двигунів.
У металургії:
для зварювання й різання металів; – прискорює горіння в доменних печах.
О2
У медицині:
подається хворим при утрудненому диханні;
використовується у кисневих подушках і балонах.
двигунах внутрішнього згоряння:
забезпечує згоряння пального;
підвищує потужність двигунів. Ваші приклади: – акваріуми з аераторами;
кисневі коктейлі;
використання в дайвінгу.
